최근 유전자편집기술에 대한 법적 규제 동향
류화신 교수 (충북대학교 법학전문대학원)
1. 유전자편집기술과 법
□ 유전자편집기술의 발전
○ 인간이나 동·식물의 세포에서 특정 유전자가 있는 DNA를 정교하게 잘라내는 유전자편집(genome editing) 기술은 오늘날 농작물이나 가축의 품종 개량, 난치병 치료 및 예방법 개발 등을 위한 강력하고 획기적인 기술로 주목받고 있음
○ 한편, 생태계 파괴, 표적이탈효과, 맞춤형 아기 제작 가능성과 같은 위험성으로 인하여 우리 사회에 안전성과 윤리성 문제를 제기하고 있음
□ 유전자편집기술 관련 국내법 규제
○ 유전자편집기술의 농업 분야에의 적용은 「유전자변형생물체의 국가간 이동 등에 관한 법률」(유전자변형생물체법, 이하 “LMO법”이라고 함)이 적용됨
○ 유전자편집기술의 인체 적용과 관련한 규정으로는 유전자치료 및 연구에 관하여 규정하고 있는 「생명윤리 및 안전에 관한 법률」(이하 “생명윤리법”이라고 함)과 유전자치료를 첨단재생의료의 범위에 포함하고 있는 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」(이하 “첨단재생바이오법”이라고 함)이 시행되고 있음
2. 유전자편집기술의 농업 분야 적용과 LMO법
□ 카르타헤나의정서와 국내 LMO법 제정
○ 우리나라는 「바이오안전성에 관한 카르타헤나 의정서」 (이하 ‘의정서’라 함) 가입 이후 유전자변형생물체의 관리를 위하여 LMO법을 제정함(2001.3.28)
* 의정서 채택일 2000.1.29., LMO법 시행 2008.1.1.
○ 유전자변형생물체(이하 “LMO”라 함)의 정의에 대하여 우리나라는 의정서와 동일하게 규정함
- LMO법에서 “LMO”라 함은 현대생명공학기술을 이용하여 새롭게 조합된 유전물질을 포함하고 있는 생물체를 말함(제2조 제2호)
- 여기서 “현대생명공학기술”은 (가) 인위적으로 유전자를 재조합하거나 유전자를 구성하는 핵산을 세포 또는 세포내 소기관으로 직접 주입하는 기술 (나) 분류학에 의한 과(科)의 범위를 넘는 세포융합기술을 의미함(제2조 제2호).
- 즉, LMO는 생물체 자체의 생식이나 번식 능력이 없는 가공식품 등을 포괄하는 유전자변형체(GMO)와 달리 살아있는(living) 생명체임을 강조하는 용어로서 생식과 번식이 가능한 경우를 뜻하며, 현대생명공학기술은 자연상태의 생리적 증식이나 재조합이 아니고 전통적인 교배나 선발에서 사용되지 않는 기술로서 유전자편집기술도 이에 해당함
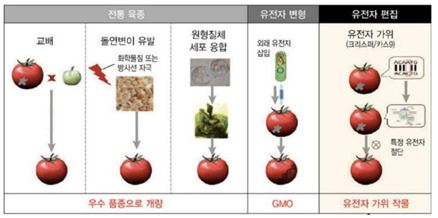
출처: 박지현·홍미영·한지학, “신육종기술(NPBTs)”, KISTEP 기술동향브리프, 한국과학기술기획평가원, 2018-04호, 8면; 네이처 제네틱스 2016년 2월호
□ 크리스퍼 유전자가위의 등장과 LMO 규제
○ LMO법에 의하면 유전자편집기술을 활용한 유전자변형의 경우에도 본 규제 범위에 포함됨
- 의정서 채택 및 국내 LMO법 제정 이후 등장한 크리스퍼 유전자가위 등 3세대 유전자편집기술은 외래 유전자가 잔존하지 않고 원하는 부위만 삭제되는 방식이므로 위험성이 적다는 주장이 있음
- 우리나라의 경우 SDN(Site Directed Nuclease)-1(유전자 제거), SDN-2(유전자 교체) 및 SDN-3(유전자 삽입) 모두 LMO에 해당하여 LMO법의 규제를 받고 있음
- 그런데 SDN-1 또는 경우에 따라서 SDN-2도 방사선이나 화학물질을 통한 유전자변형보다는 자연상태에서의 유전자변형에 가까워 LMO에 포함하지 않아야 한다는 주장이 힘을 얻고 있음
○ 유전자편집기술을 활용한 LMO의 규제 여부를 둘러싸고 국가별로 상이한 접근방식을 보임
- 미국(의정서 비가입국)은 유전자편집기술을 활용한 LMO를 대부분 규제 대상에서 제외함
* 미국은 SDN-1의 경우와 SDN-2 중에서 단일 염기쌍 교체에 국한된 경우, 그리고 SDN-3 중에서 전통육종 기술을 이용해 교배와 후손 생산이 가능한 식물에서 유래한 염기서열을 삽입한 경우에는 규제 대상이 아닌 것으로 규정(2020년 7 CFR Part 340 개정)
- 유럽연합(EU)의 경우 ① 2018년 7월 사법재판소에서 유전자편집기술이 활용된 경우에도 LMO로 보아 동일한 안전규제를 받아야 한다는 판결을 내린 바 있으나, ② 2023년 7월 집행위원회는 유전자편집기술(또는 관련 산물)을 ‘신유전체기술(New Genomics Techniques; “NGT”라고 함)’로 명명하고 기후위기 대안으로서 위 NGT 작물에 대한 새로운 규제를 제안하였으며, ③ 2024년 1월 24일 유럽의회 환경위원회에서는 부속서 I에 명시된 기준(기존 작물과의 동등성 기준)을 충족하는 NGT 작물에 대해서는 검증 절차 후 일반 작물과 동등하게 취급하겠다는 규제 완화 방안을 통과시킴
* NGT 작물은 생물정보학적 도구로 예측할 수 있는 표적 부위와 서열의 유사성을 공유하는 모든 DNA 서열에서 아래 1-5호에 언급된 유형의 유전자변형이 20개 이하인 경우에 기존 식물과 동등한 것으로 간주 (1) 20개 이하의 뉴클레오타이드의 치환 및 삽입 (2) 임의의 수의 뉴클레오타이드의 삭제 (3) 유전자변형이 내인성 유전자를 억제하지 않을 조건 (4) 임의의 수의 뉴클레오타이드 서열의 표적 전위 (5) 생성된 DNA 서열이 육종가의 유전자 풀의 종에서 이미 발생한 적이 있는 경우에 한하여 모든 크기의 기타 표적 변형
□ 최근 LMO법 개선 동향
○ 2022년 7월 22일, 신규 유전자변형생물체에 대한 위해성심사 등의 면제 규정(제7조의3)을 신설하는 LMO법 개정안(정부)이 제출되었고 현재 국회 계류 중에 있음
- 개정안에 따르면 신규 유전자변형생물체를 개발한 자 등은 해당 유전자변형생물체가 ① 외래 유전자를 도입하지 않고 유전자변형생물체를 만든 경우 또는 ② 외래 유전자를 도입하였으나 최종산물에 외래 유전자가 남아있지 않은 경우에는 국가책임기관의 장에게 위해성심사 등의 면제를 신청할 수 있도록 함
- 이때 국가책임기관의 장은 신규 유전자변형생물체가 전통육종이나 자연적 돌연변이 수준의 안전성을 확보하였다고 인정되는 경우에는 위해성심사 등을 면제할 수 있도록 규제를 완화하고자 함
□ 평가
○ 유전자편집기술을 활용한 유전자변형생물체를 LMO법의 규제 대상에 포함시킬 것인가는 과학적 판단만이 아니라 이를 토대로 다양한 방법으로의 의견수렴을 통한 사회적 합의 사항이자 국가의 정책적 과제라고 볼 수 있음
- 종래 LMO 여부를 판단하는 기준에는 최종산물을 중심으로 삼는 프로덕트(product) 기준과 개발과정에서 이용된 기술을 염두에 두는 프로세스(process) 기준으로 구분되며, 전자의 경우는 최종산물에 외래유전자의 잔존 여부가, 후자의 경우에는 현대생명공학기술 이용 여부가 핵심임
- 우리 LMO법은 프로세스 기준으로서 현대생명공학기술이 개입된 최종산물은 LMO에 해당하며 외래유전자의 잔존 여부를 고려하지 않음으로써 의정서 이후 등장한 유전자편집기술의 구체적 형태나 안전성 정도를 반영하지 않는 획일적 방식을 취하게 되었으며 유전자편집 신기술의 발전에도 장애 요소로 작용됨
○ LMO법 개정안은 전통육종이나 자연적 돌연변이 수준의 안전성이 확보되었음이 증명된 경우에는 엄격하고 복잡한 위해성심사 등을 면제받을 수 있는 근거조항을 신설하는 방식으로 제안됨
- 국제적 동향과 유전자편집 신기술의 안정성 정도 등을 고려한 규제 완화 방안으로 제시됨
- 용어 사용에 있어서 현행법상 ‘신규 유전자변형생물체’의 용어를 그대로 사용함으로써 EU의 ‘신유전체기술(NGT)’이라는 새로운 용어 도입과는 구별되는 입장에 있음
- 규제 완화를 위해서도 유전자편집 최종산물을 LMO의 ‘정의’ 규정에서 제외시키는 방안(일본)과 정의로는 LMO이지만 법의 ‘적용범위’에서 제외시키는 방안(EU 개정안) 중 후자의 입장을 취함
3. 유전자편집기술의 의료 분야 적용에 대한 생명윤리법 및 첨단재생바이오법의 변화
□ 유전자치료 연구에 관한 생명윤리법의 입장
○ 유전자치료의 정의 변경
- 종래 ‘질병의 예방 또는 치료를 목적으로 유전적 변이를 일으키는 일련의 행위’에서 2015년 12월 29일 법 개정을 통하여 ‘질병의 예방 또는 치료를 목적으로 인체 내에서 유전적 변이를 일으키거나, 유전물질 또는 유전물질이 도입된 세포를 인체로 전달하는 일련의 행위’로 유전자치료의 정의를 변경함
○ 유전자치료 연구의 범위는 제한적이지만, 보다 다양한 연구가 가능하도록 요건을 완화함
- 유전자치료에 관한 연구는 유전질환, 암, 후천성면역결핍증, 그 밖에 생명을 위협하거나 심각한 장애를 불러일으키는 질병의 치료를 위한 연구(질병요건)와 현재 이용 가능한 치료법이 없거나 유전자치료의 효과가 현저히 우수할 것으로 예측되는 치료를 위한 연구(치료법요건)에 한하여 제한적으로 허용됨(제47조 제1항)
- 2015년 12월 29일 법 개정을 통해 질병 요건과 치료법 요건 모두에 해당하는 경우에만 연구할 수 있다고 한 입장에서, 2020년 12월 29일 법 개정을 통하여 둘 중 어느 하나에 해당하는 경우에는 수행 가능한 것으로 요건 완화됨
- 법 개정을 통한 연구 요건의 완화로 인하여 발생할 수 있는 위험성 등을 보완하기 위하여 연구계획서에 대한 기관위원회의 심의를 의무화하고, 위험성 및 신규성이 높은 연구 등에 대해서는 기관위원회가 국가위원회의 자문을 받도록 하며(제47조 제2항), 유전자치료에 관한 연구 허용 요건을 위반한 경우 또는 연구계획서에 대하여 기관위원회의 심의를 받을 의무를 위반한 경우 등에 대하여 업무정지처분에 갈음한 과징금 부과 규정을 신설함(제58조)
○ 배아 등을 대상으로 한 유전자치료는 엄격히 금지되며(제47조 제5항), 배아에 대한 유전자치료에 관한 연구는 별도 명문의 규정이 없음
- 생명윤리법상 배아를 연구에 이용하는 행위 자체가 금지되고 있지는 않으며, 배아에 대한 유전자치료 연구 또한 결국 배아 연구에 관한 규정을 따르는 것으로 해석됨
- 따라서 임신 외의 목적으로 배아 생성을 금지하며(제23조 제1항), 보존기간이 지난 잔여배아를 원시선이 나타나기 전까지 제한된 범위 내에서만 연구 가능하므로(제29조 제1항), 배아 대상 유전자치료 연구도 생명윤리법시행령 제12조에 열거된 총 21종의 희귀·난치병 치료를 위한 연구 목적으로만 가능하다고 해석할 수 있음
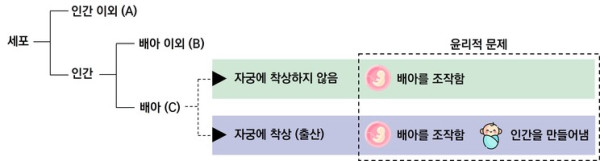
<그림 2> 인간 배아 유전자편집에 수반되는 윤리적 문제점
출처: 藤田みさお, “ヒト胚へのゲノム編集(前編)”, 京都大学iPS細胞研究所 CiRA Newsletter(23): 2015.10, p.12.
○ 최근 크리스퍼 유전자가위 기술의 발달에 따라 생명윤리법에 배아 대상 유전자치료 연구에 관한 명확한 법규정의 마련이 필요함
- 인간 배아 단계에서 유전자치료의 타당성에 관한 논의는 안전성, 윤리성, 형평성 등 여전히 복잡한 사회적 이슈임
- 치료효과의 다음 세대로의 영향력, 예상 밖의 표적이탈효과, 다음 세대로부터의 충분한 설명에 근거한 동의(informed consent) 수령 불가, 맞춤형 아기(designer baby) 생산의 우려, 경제적 격차에 따른 치료 혜택의 불평등과 사회적 차별의 부작용, 덧붙여 자유주의적 우생학(liberal eugenics)이 야기할 수 있는 문제로서 부모가 자녀를 더 나은 상태로 개선시키지 않은 것에 대한 사회적 압박과 개인의 책임이 무한 증폭될 수 있다는 점과 차별에 따른 사회적 연대감 파괴가 지적되는 등 전 세계적으로도 배아에 대한 유전자치료 시행은 현재 불가함이 타당함
- 다만 배아에 대한 유전자편집 연구의 허용 범위와 관련하여, 현행법상 배아 연구 규정은 2004년 생명윤리법시행령 제정 당시 배아 연구의 윤리적 민감성과 초기 단계 줄기세포 연구의 특수성을 고려하여 마련되었던 규정이므로 과연 오늘날 배아 유전자치료 연구에 적용하여도 무방한 것인지는 의문이 생길 수밖에 없음
□ 유전자치료 임상연구 및 유전자치료제 등에 관한 첨단재생바이오법의 최근 개정
○ 유전자치료 등의 특수성을 반영하고 첨단재생의료 임상연구 및 첨단바이오의약품의 안전 관리 등을 위하여 첨단재생바이오법이 제정되었으나 곧 한계에 부딪힘
- 의약품으로의 개발 외에는 임상적용 경로가 없던 상황에서 첨단재생의료 임상연구 활성화를 통한 희귀·난치 질환의 치료기회 확대 등을 위해 첨단재생바이오법 제정(2019.8.27)
- 그러나 연구대상자의 범위 협소(대체치료제가 없거나 생명을 위협하는 중대한 질환, 희귀·난치 질환을 가진 사람) 등 임상연구가 제한적으로 이루어지고, 또 연구 목적으로만 실시될 뿐 치료는 금지되어 있어서 환자의 치료받을 권리가 제약되고 일본 등 해외로의 원정 치료와 국내 음성적 시술이 양산되는 사회적 문제가 대두되고, 종국에는 첨단재생의료기술의 발전이 저해되고 있다는 지적이 제기됨
- 2024년 2월 1일, 국내에서도 첨단재생의료 치료를 가능하도록 하는 첨단재생바이오법 개정안(제안자: 보건복지위원장)이 국회 본회의를 통과함(공포 후 1년이 경과한 날부터 시행)
○ 2024년 첨단재생바이오법 개정안의 주요 내용은 다음과 같음
- 첨단재생의료 임상연구의 대상자에 대한 제한을 폐지함
- 첨단재생의료 치료를 허용하되 치료대상자(대체치료제가 없거나 생명을 위협하는 중대한 질환, 희귀·난치질환 등을 가진 사람) 및 위험도(고·중·저위험으로 분류)에 따라 단계적으로 허용함
- 첨단재생의료의 안전성이 보장되도록 하는 종합적인 안전관리체계를 마련함
- 적정한 치료비용이 청구될 수 있도록 정보 공개 및 사전 심의 등 규율체계를 마련함
- 재생의료기관이 환자 본인으로부터 유래한 세포를 최소한의 조작을 통하여 첨단바이오의약품의 원료로 공급하는 경우에 인체 세포 등 관리업의 허가를 받은 것으로 간주함

<그림 3> 2024년 첨단재생바이오법 개정안 주요 내용
4. 향후 과제
□ LMO법
○ 유전자편집기술을 이용한 유전자변형은 종래 LMO법과는 차별화된 규제 도입이 필요함
- 외래 유전자가 도입되지 않았거나 잔존하지 않는 경우에는 새로운 위험요소가 없고 자연적 돌연변이와 동일하며 기술적으로 유전자교정 여부를 구분하기 어렵다는 점과 전통적인 육종기술보다 변이 유도가 더 정밀하고 예측 가능하다는 점 등이 고려되어야 함
- 의정서에 기반한 LMO법이 법 제정 이후 개발된 신기술을 포함하는지 여부에 대한 법 정의의 모호함과 법 적용의 불합리함에 대한 대응을 위하여 ‘신규 유전자변형생물체’와는 구별되는 용어의 도입, 프로덕트 기반 체계로의 전환, 급격한 유전자가위기술의 발전 상황을 반영하여 (LMO법 내에서라도) 유전자편집기술을 이용한 유전자변형생물체의 별도 규율체계가 필요하다고 봄
○ 인체와 구분되는 농업 분야에서의 안전성에 상응하는 방식으로의 입법 태도가 필요
- 편집 부작용으로서의 표적이탈효과는 의료 분야 인체용 의약품에서 매우 우려되는 사항이며, 농업 분야 작물 육종에서는 오히려 우수형질 선택권을 향상시키기도 하는 등 인체에서처럼 크게 우려할 사항이 아님
- LMO법 제3조에 의하여 인체용 의약품으로 사용되는 LMO에 대해서는 본 법 적용을 배제하고 있는 점 등에 입각하여 유전자편집기술의 안전성 고려는 인체용과 구분하여 논의되어야 함
□ 생명윤리법
○ 배아 대상 유전자치료 연구 규정 신설 및 연구 범위에 관한 입장 설정이 필요함
- 생명윤리법상 배아 대상 유전자치료 금지 규정은 존재하지만, 배아 대상 유전자치료 연구에 관한 직접적 규정은 존재하지 않으므로 규정 신설이 필요함
- 배아에 대한 유전자치료 연구 대상 질병의 범위 또한 법령 해석상 갈등이 존재할 수 있으므로 이를 방지하고자 명확히 규정함이 필요함
○ 유전자치료에 관한 연구 요건 및 심의 절차의 조정이 필요함
- 유전자치료에 관한 연구는 질병 요건과 치료법 요건 중 어느 하나에 해당하는 경우에 수행 가능하도록 이미 규제 완화되었지만, 최근 (폭넓은 사회적 논의와 숙고의 과정을 거쳤는가는 별론으로 하고) 첨단재생의료 임상연구의 대상자 제한을 폐지하는 첨단재생바이오법 개정안이 국회 본회의를 통과함에 따라 생명윤리법의 조정(완화)이 불가피하다고 봄
- 또 생명윤리법상 위험성 및 신규성이 높은 유전자치료 연구 등의 심의에 있어서는 국가위원회에 대한 자문 요청 및 심의 결과 보고, 자료 제출 등의 절차가 추가되고 있는 반면, 첨단재생바이오법에 근거한 고위험 첨단재생의료 임상연구 계획은 신속·병합 검토 절차의 도입 등 고시 제개정 작업이 추진되어 절차가 간소화되고 승인까지의 시간이 단축되도록 개선하고 있는바, 생명윤리법도 기관위원회의 심의 기준과 절차, 국가위원회에 대한 자문 요청 절차 등이 합리적이고 간소화되도록 검토할 필요가 있음
* 식약처: 「고위험 첨단재생의료 연구계획 승인 절차 및 방법 등에 관한 규정」 제정(’23.6월)
복지부: 「첨단재생의료 연구계획 작성·제출 및 심의 등에 관한 규정」 개정(’23.7월)
□ 첨단재생바이오법
○ 최근 법 개정으로 대폭 규제 완화됨에 따라 첨단재생의료 임상연구의 활성화 및 산업화가 기대되고 있는 상황임
○ 향후 환자 안전성과 관련한 공적 관리시스템의 운용, 피해 발생 시 책임 문제 등에 대한 사회적 논의와 법적 검토가 필요함
* 본 기고문은 과학기술정보통신부에서 시행한 「유전자편집·제어·복원기반기술개발사업」수행의 일환으로 작성되었습니다.
* 본 내용은 유전체편집연구지원사무국(GERC)의 의견과 다를 수 있음을 밝힙니다.
* 인용, 발표하실 때에는 반드시 출처를 밝혀주시기 바랍니다.