in vivo 간 표적 유전자편집 치료제 임상 개발 동향
이재영 교수 (성균관대학교)
1. 개요
유전자편집 기술은 난치성 유전 질환의 근본적인 치료 가능성을 제시하며 빠르게 발전하고 있다. 특히 환자의 체내로 직접 유전자편집 도구를 전달하는 in vivo 방식은 체외에서 세포를 조작하여 주입하는 ex vivo 방식에 비해 복잡한 제조 공정을 단축하고, 전달체에 따라 다양한 조직 및 세포에 적용할 수 있다는 장점이 있다.
‘간(liver)’은 혈장 단백질의 대부분을 생산하는 대사 및 해독의 중심지로서, 임상개발 단계인 대부분의 유전자편집 도구 전달체가 전신 투여되었을 때 자연스럽게 축적되는 장기이다. 현재 개발 중인 in vivo 유전자편집 치료제의 가장 주된 표적이 되는 이유다.
CRISPR/Cas9을 필두로 한 최근의 유전자가위 기술은 LNP(lipid nanoparticle) 등의 비(非)바이러스성 전달체와 결합해 간 표적 질환 치료를 위한 임상 단계(clinical stage)에 잇달아 진입하는 추세다.
본 기고문에서는 방대한 전임상연구들을 나열하기보다, 실제 환자를 대상으로 진행 중인 임상 단계의 in vivo 간 표적 유전자편집 치료제 현황을 집중적으로 살펴보았다.
또 최근 이슈가 된, 임상 과정에서 발생한 안전성 문제를 통해 향후 개발 방향을 전망해보고자 한다.
2. in vivo 간 표적 유전자편집 도구 전달체 개발 현황
in vivo 유전자편집의 성패는 유전자가위를 표적 장기인 간세포(hepatocyte)까지 얼마나 안전하고 효율적으로 전달하느냐에 달려 있다. 현재 임상에서 활용되거나 개발 중인 주요 전달체는 다음과 같다.
· LNP : 현재 유전자편집 기반 in vivo 간 표적 임상에서 가장 주목받는 기술이다. CRISPR/Cas9의 경우 Cas9 mRNA와 sgRNA를 LNP에 봉입하여 정맥 투여하면, 혈중 ApoE(아포지단백 E)와 결합해 간세포의 ApoE 수용체인 LDLR(저밀도 지질단백질 수용체)을 경유하여 세포 내로 유입된다(그림 1).
바이러스 벡터와 달리 일시적으로만 발현되고 사라지므로 장기간 발현으로 인한 오프타겟(off-target) 부작용과 면역원성 위험이 상대적으로 낮다. 미국의 Intellia Therapeutics(이하 Intellia), Verve Therapeutics(이하 Verve) 및 CRISPR Therapeutics 등이 이 방식을 채택하고 있다.
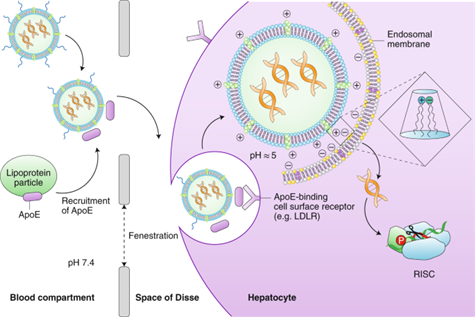
<그림 1> 간세포 표적 LNP기반 유전자 전달 경로
출처: Akinc et al., Nat Nanotechnol 2019
· AAV(adeno-associated virus): 임상 적용이 가장 활발한 유전자 치료제 전달체로서, 많은 문헌을 통해 그 안전성과 유효성이 입증된 바 있다. 세포 내로 전달된 유전자 치료제 탑재 AAV는 episome을 형성하여 세포분열이 없는 한, 장기간 transgene 발현을 유지할 수 있다(그림 2).
Cas9 등 큰 사이즈의 유전자편집 도구를 탑재하기 어려운 용량 제한(최대 약 4.7Kb)과 장기간 발현 시 편집 도구의 지속 발현에 따른 오프타겟 부작용 등에 대한 우려가 있다. 이로 인해 최근 임상 단계 in vivo 편집 분야에서는 LNP보다 비중이 낮아지고 있다.
하지만, 간 특이성을 높이기 위해 AAV 캡시드를 개량하거나 유전자편집 도구의 단기 발현을 도모하기 위해 AAV 벡터를 개량하는 연구들이 진행되는 추세다. 또 유전자편집 도구는 LNP 등의 비바이러스 형태로 전달하고, knock-in을 위한 donor 전달은 AAV를 활용하는 등의 연구 역시 진행 중이다.
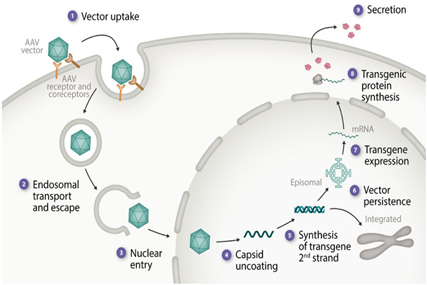
<그림 2> AAV의 세포 내 전달 이후 transgene 발현
출처: Batty and Lillicrap, Hemasphere 2021
· VLP (virus-like particles): 바이러스의 감염 효율과 비바이러스성 전달체의 안전성을 결합한 차세대 전달체다. 유전물질 없이 단백질 형태의 RNP(ribonucleoprotein)를 직접 전달하거나 mRNA를 전달하는 방식으로 개발되고 있으며, 간 외의 다른 장기 표적해 개발 중이다.
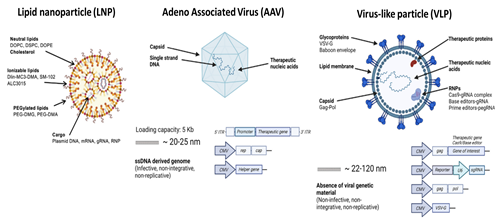
<그림 3> 체내 유전자편집을 위한 주요 전달체
출처: Cavaza et al., Mol Ther Nucleic Acids 2025
3. in vivo 간 표적 유전자편집 기반 임상개발 현황
현재 임상시험을 진행 중인 간 표적 파이프라인은 희귀 유전 질환에서 시작하여 심혈관 질환, 감염성 질환으로 그 적용 범위가 확대되고 있다. 대부분의 간 표적 유전자편집 기반 임상 개발은 LNP를 활용하고 있다.
3.1. 희귀 질환(rare disease)
희귀 질환은 in vivo 유전자편집의 가능성이 가장 먼저 입증된 분야다.
· ATTR 아밀로이드증: Intellia의 ‘NTLA-2001’은 세계 최초로 임상에 진입한 전신 투여 in vivo CRISPR 치료제다. 간에서 비정상적인 TTR 단백질을 생성하는 유전자를 영구적으로 불활성화(knock-out)하여 질병 진행을 막는다.
현재 임상 3상 단계로, 단 1회 투여로 혈중 TTR 농도를 급격히 감소시키는 결과를 발표한 바 있다(그림 4).
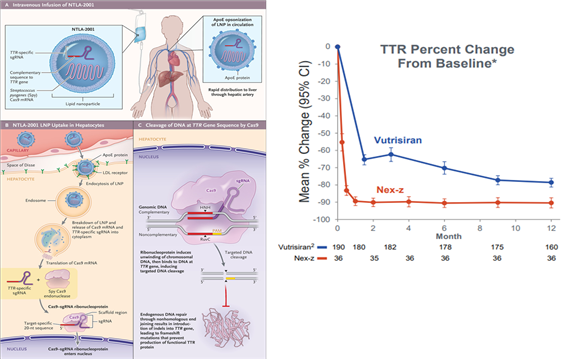
<그림 4> NTLA-2001의 치료기전 및 임상1/2상 결과
출처: Gilmore et al., N Engl J Med, 2021
Fontana et al., N Engl J Med, 2024
Gilmore etal., N Engl J Med. 2024
· 유전성 혈관부종(HAE): HAE는 C1 억제제 결핍 또는 기능 장애로 발생하는 유전성 질환이다.
Intellia의 NTLA-2002는 혈관 확장, 혈압 강하, 염증 유발 및 통증 전달에 관여하는 bradykinin의 과도한 생성을 막기 위해 KLKB1 유전자를 편집하도록 설계되었다.
현재 임상 1/2상 단계인 NTLA-2002는 단회 투여만으로 환자들의 발작 빈도를 90% 이상 감소시키는 고무적인 결과를 보였다(그림 5).
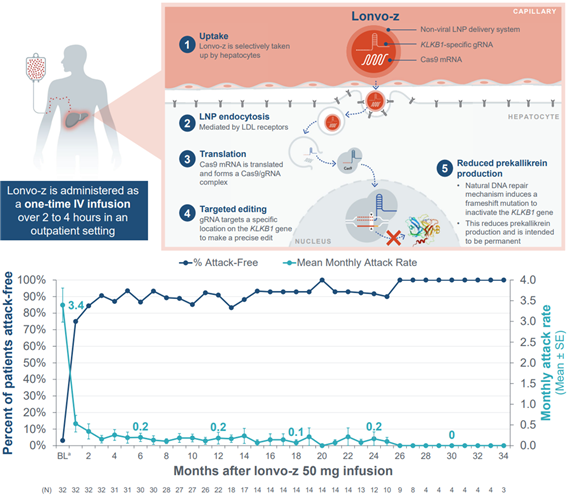
<그림 5> NTLA-2002의 치료기전 및 임상 1/2상 결과
출처: Cohn et al., Abstract 8062/D007. ACAAI Congress 2025 Nov 6-10
Cohn et al., N Engl J Med 2025
· 제1형 원발성 고수산뇨증(PH1): PH1은 간 특이적인 효소인 알라닌-글리옥실산 아미노전이효소(AGT) 결핍으로 인해 발생하는 희귀 유전 질환이다. 글리옥실산이 글리신으로 전환되지 못하고, 대신 과도한 양의 옥살산으로 전환되어 신장 손상을 유발한다.
Arbor Biotechnologies가 개발 중인 in vivo 유전자편집 치료제 ‘HAO’는 CRISPR/Cas9 기술을 LNP로 전달하여 옥살산 생성에 기여하는 HAO1 유전자를 비활성화시키도록 설계됐다.
· 오르니틴 트랜스카바밀라제(OTC) 결핍증: OTC 결핍증은 간에서 암모니아를 해독할 때 필요한 OTC 효소 결핍으로 혈중 암모니아가 축적되는 유전질환이다.
iECURE의 ‘ECUR-506’은 Precision BioSciences(이하 Precision)와 함께 개발 중인 ‘ARCUS’ 유전자편집 기술을 기반으로, AAV 벡터를 이용해 핵산 분해효소와 정상 OTC 유전자를 간세포에 전달한다. 유전자가위가 간세포의 PCSK9 유전자 부위를 절단하면 정상 OTC 유전자가 그 위치에 삽입(gene insertion/knock-in)되어 기능성 단백질을 지속적으로 발현시키는 기전을 갖는다. 현재 임상 1/2상(OTC-HOPE)을 진행 중이다.
· 혈우병(hemophilia): 기존의 유전자 대체(replacement) 요법을 넘어, 특정 유전자 위치에 정상 유전자를 삽입(insertion)하는 방식으로, 보다 더 안정적인 유전자 발현을 도모하는 연구가 진행되고 있다.
Intellia Therapeutics와 Regeneron이 공동 개발해, 현재 Regeneron에서 임상을 진행하고 있는 ‘REGV131-LNP1265’은 B형 혈우병의 결핍 유전자인 F9를 LNP에 탑재해 투여함으로써 체내에서 F9 단백질 생성을 유도하게 된다. 현재 B형 혈우병 임상 1/2상을 통해 유효성 및 안전성을 평가 중이다.
3.2. 심혈관 질환 예방(cardiovascular prevention)
in vivo 유전자편집 치료제 적용 분야는 희귀 질환을 넘어 대중적인 만성 질환으로 확장되고 있다. 약을 평생 복용해야 하는 고지혈증 등의 만성 질환 치료를 'one-and-done(단회 투여)' 치료로 전환하려는 시도가 그것이다. 이 분야의 핵심 목표는 간세포에서 혈중 지질 대사를 조절하는 단백질의 발현을 영구적으로 낮추는 것이다.
· PCSK9(Proprotein Convertase Subtilisin/Kexin Type 9): PCSK9은 간세포 표면의 LDL 수용체를 분해하여 혈중 LDL 콜레스테롤 수치를 높이는 핵심 조절인자이다. PCSK9 유전자를 편집해 영구적으로 knock-out 시킴으로써 간세포의 LDL 수용체가 혈중 LDL 콜레스테롤을 제거하는 역할을 제대로 수행하도록 하는 원리다.
Verve의 ‘VERVE-101’ 및 ‘VERVE-102’는 염기 편집(base editing) 기술을 이용하여 간세포 내 PCSK9 유전자의 특정 염기 하나를 치환하여 영구적으로 불활성시킨다.
이형접합 가족성 고콜레스테롤혈증(HeFH) 임상 1상에서 VERVE-102는 단회 투여로 혈중 LDL 콜레스테롤 수치가 50% 이상 감소됐다는 연구결과가 발표된 바 있다(그림 6).
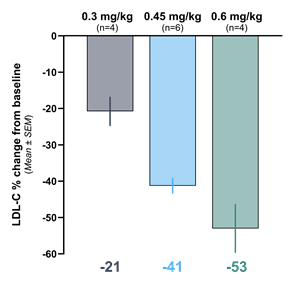
<그림 6> VERVE-102의 임상1상 중간 결과
출처: Verve Therapeutics webpage (vervetx.com/our-programs/verve-102)
· ANGPTL3(Angiopoietin-Like 3): ANGPTL3 단백질은 지단백질 분해효소(LPL, EL)를 억제하여 혈중 중성지방(triglycerides) 및 콜레스테롤 수치를 높이는 역할을 한다. ANGPTL3 기능 상실(Loss-of-Function) 변이를 가진 사람은 혈중 중성지방과 LDL 콜레스테롤 수치가 매우 낮은 것으로 알려져 심혈관 질환 위험이 낮은 것으로 보고되었다.
CRISPR Therapeutics는 ANGPTL3 유전자를 표적하는 CRISPR/Cas9 nuclease ‘CTX-310’를 Verve는 같은 기전의 base editor(염기교정기) ‘VERVE-201’을 개발하고 있다.
현재 CTX-310은 고지혈증, 고중성지방혈증, 혼합 이상지질혈증 환자 대상 임상 1상을 진행 중이다. CTX-310 단회 투여 후 90일 관찰 결과, 혈중 LDL 콜레스테롤이 48%, 중성지방이 55% 이상 감소한 것으로 나타났다.
VERVE-201은 재발성 고콜레스테롤혈증 임상 1b상의 첫 환자에 대한 투여가 완료된 상태다.
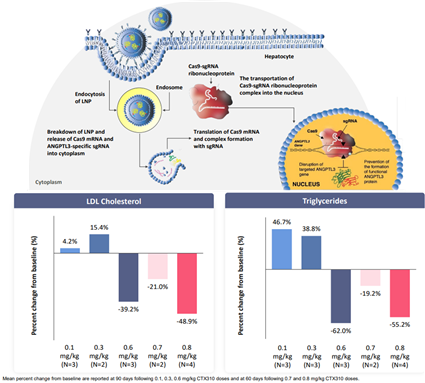
<그림 7> CTX-310의 치료기전 및 임상1상 중간 결과
출처: CRISPR Therapeutics corporate presentation Q4 2025
Laffin et al., N Engl J Med. 2025
· LPA(Lipoprotein(a)): Lp(a)는 혈중 콜레스테롤을 운반하는 특정 지단백질로, 일반적인 콜레스테롤과 달리 유전적으로 Lp(a) 수치가 결정되며 죽상동맥경화증 및 심근경색의 독립적 위험 인자로 알려져 있다.
LPA 유전자를 편집하여 Lp(a) 단백질 생성을 감소시키는 기전으로, CRISPR Therapeutics의 ‘CTX-320’ 및 Verve의 ‘VERVE-301’ 등의 in vivo 유전자편집 기반 치료제가 개발되고 있다.
최근 우리나라의 툴젠이 홍콩의 GenEditBio와 LNP-CRISPR를 활용하여 LPA 유전자편집 치료제를 공동개발하는 내용의 협업 계약을 체결하고 현재 임상시험을 준비 중이다.
3.3. 감염성 질환(infectious disease)
만성 B형 간염의 완치가 어려운 이유는 간세포 핵 내의 cccDNA(Covalently Closed Circular DNA)를 영구적으로 제거 또는 비활성화가 어렵기 때문이다.
B형 간염 치료를 위한 유전자편집 치료제는 핵 외 영역에 비정상적으로 삽입된 통합(integrated) HBV DNA와 cccDNA를 동시에 표적하여 바이러스가 다시 활성화되지 않는 상태의 기능적 완치(functional cure)를 추구한다.
· 핵산분해효소 접근(Nuclease Approach): Precision의 ‘PBGENE-HBV’는 자사의 ARCUS 플랫폼을 활용한다. ARCUS는 메가뉴클레아제(meganuclease) 기반 유전자가위로, 통합 HBV DNA와 cccDNA를 직접 절단(cleavage)·파괴하는 방식이다. LNP를 통해 간세포에 전달된다.
현재 임상1상 진행 중이며 CRISPR 외의 유전자가위가 간 표적 임상 단계에 진입한 주요 사례라 할 수 있다.
· 후성유전체 편집 접근(Epigenome Editing): Tune Therapeutics의 ‘TUNE-401’은 후성유전체 편집 기술을 이용한다.
TUNE-401은 DNA 절단 대신 DNA 메틸화를 조절하여 통합 HBV DNA와 cccDNA를 동시에 침묵(silencing)시키는 기전을 갖는다. DNA 절단에 따른 유전체 손상을 최소화할 수 있다는 점에서 새로운 대안으로 떠오르고 있다.
LNP를 통해 체내에 전달되며 현재 임상 1상 진행 중이다.
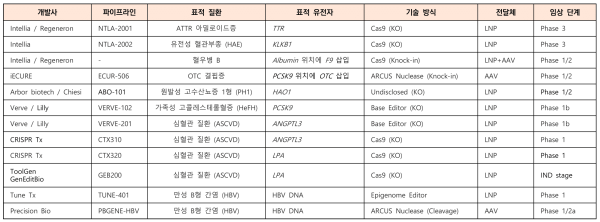
<표 1> 주요 간 표적 유전자편집기반 치료 후보물질의 임상개발 현황
(클릭하면 표를 크게 보실 수 있습니다)
4. LNP-유전자편집 치료제 임상의 안전성 이슈와 위험 완화 노력
in vivo 유전자편집 치료제는 기존 의약품과는 차원이 다른 영구적 효과를 제공하지만, 그만큼 안전성 확보가 중요하다.
하기 두 사례를 통해, LNP 기반 in vivo 유전자편집 치료제는 영구적인 치료 효과에 대한 장점과 함께 기저 질환이 심각한 환자의 투여는 신중해야 한다는 과제를 동시에 갖고 있음을 알 수 있다.
임상 단계에서 발생하는 안전성 관련 이슈는 관련 업계 전체에 중대한 의미를 시사한다.
4.1. Intellia의 ATTR 임상 중 환자 사망
CRISPR/Cas9을 LNP에 탑재한 Intellia의 NTLA-2001은 전신 투여 in vivo 유전자편집 치료제로서 가장 앞선 임상 단계에 있다.
하지만 최근 ATTR 심근병증 환자 대상 임상 3상 연구(MAGNITUDE) 중, NTLA-2001을 투여한 고령의 환자에서 약 한 달 후 4등급의 간 독성 (elevated transaminases)이 관찰되었고, 결국 36일차에 사망했다.
현재까지 NTLA-2001을 투여받은 450명의 환자 중 1% 이하에서 4등급 간 독성이 보고되었다.
관련 임상은 즉시 중단됐으며 Intellia는 현재 사인을 조사 중이다.
이는 중증 질환 환자 대상 유전자 치료제 임상은 기저 질환과 약물 부작용을 명확히 구분하고 장기적인 안전성 모니터링이 필수임을 강조되는 사례라 할 수 있다.
4.2. Verve의 PCSK9 임상 중 환자 사망 및 위험 완화 노력
Verve의 심혈관 질환 예방 치료제인 VERVE-101 임상 1b상에서도 고용량을 투여한 환자의 사망례가 발생했다. Verve는 사망 원인에 대해, 환자의 기저 질환인 진행성 죽상경화성 심혈관 질환(ASCVD)과 관련이 있으며 VERVE-101과는 무관하다고 발표했다.
Verve는 이를 계기로, 안전성 프로파일을 강화한 후속 파이프라인 ‘VERVE-102’를 개발 중이다. VERVE-102는 VERVE-101과 동일한 편집도구를 사용하지만 LNP의 구성 성분을 최적화하여 간 표적 특이성을 높이고 간 외 조직으로의 노출을 최소화하도록 설계되었다.
VERVE-102의 이러한 개발 방향은 잠재적 오프타겟 또는 간 외 조직 부작용의 위험을 줄이고 보다 안전한 투여 용량과 프로토콜을 설정하는 데 중점을 둔다.
이는 LNP를 활용하는 in vivo 유전자편집 치료제 개발에 있어 전달체의 안전성 최적화가 핵심적인 위험 완화(risk mitigation) 전략임을 보여준다.
6. 맺음말 (Conclusion)
in vivo 간 표적 유전자편집 치료제는 희귀 유전 질환 치료를 넘어 심혈관 및 감염성 질환으로 그 영역을 확장하며 의료 패러다임을 바꾸고 있다.
LNP, AAV 등의 전달체 기술과 CRISPR, Base Editor, ARCUS, Epigenome Editor 등 차세대 편집 기술의 도입은 치료의 정밀도와 안전성을 높이고 있다.
특히 iECURE의 OTC 결핍증 치료제 및 Intellia의 혈우병 치료제와 같은 유전자 삽입(knock-in) 기술의 임상 단계 진입은 단백질 기능 결핍 질환 치료의 새로운 가능성을 열고 있다.
그 외에도 Verve, CRISPR Therapeutics, Precision 등의 선도 기업들이 임상 후기 및 초기 단계에 활발히 진입함에 따라, 머지않아 최초의 in vivo 유전자편집 신약이 탄생할 것으로 기대되고 있다.
다만, 임상시험 중 발생하는 안전성 이슈는 유전자편집 치료제 개발에 있어 전달체 최적화, 신중한 환자군 선정, 그리고 장기적인 안전성 모니터링이 여전히 최우선 과제임을 상기시킨다.
한국의 연구자들과 기업들도 이러한 글로벌 최신 동향을 면밀히 파악하고, 차별화된 타겟 발굴과 전달체 기술 확보를 통해 글로벌 경쟁력을 갖춰 나가야 할 시점이다.
* 본 기고문은 과학기술정보통신부에서 시행한 「유전자편집·제어·복원기반기술개발사업」수행의 일환으로 작성되었습니다.
* 본 내용은 유전체편집연구지원사무국(GERC)의 의견과 다를 수 있음을 밝힙니다.
* 인용, 발표하실 때에는 반드시 출처를 밝혀주시기 바랍니다.