첨단바이오의약품 국내외 규제 동향과 실사례
-유전자치료제 위주-
한국규제과학센터 박규형
손성구
1. 첨단바이오의약품과 규제의 새로운 역할
첨단바이오의약품, 특히 유전자치료제는 희귀·난치 질환이나 유전질환 분야에서 기존 의약품의 한계를 극복할 수 있는 ‘혁신 치료제’로 자리매김하고 있다. 그러나 과학적 잠재력과 달리, 장기 안전성·윤리·품질·사회적 수용성 등 다양한 리스크로 인해 글로벌 규제 환경의 새로운 기준이 필요하다.이들 치료제는 탁월한 치료 가능성을 제공하는 반면, 기존 소분자 및 단백질 의약품과 판이한 제조공정, 윤리·사회적 이슈, 장기 안전성 리스크를 안고 있다. 따라서 규제는 혁신과 위험 사이 균형을 맞추는 역할로, 과거의 ‘장벽’에서 이제는 ‘글로벌 진입과 환자 신뢰’의 관문으로 전환되고 있다.
본 고에서는 최근(2024~2025년)의 글로벌 규제 동향, 각국의 실사례, 향후 실무적 시사점까지 종합적으로 살펴보고자 한다.
2. 글로벌 규제 환경의 변화와 동향
2.1 미국 FDA
미국 FDA는 유전자치료제(유전자편집 기술 등 포함)에 대해 2024~2025년 기준, 안전성·투명성·책임 준수를 최우선 과제로 삼고 정책을 강화하고 있다. 최근에는 환자 세포의 해외 반출이나 국외 임상시험 등에 대해 엄격히 제한하고, 미국(또는 우방국) 내 임상 진행 및 동의서 절차를 대폭 강화했다. 2025년 최신 FAQ·가이드라인에 따르면 포괄수가제(DRG: Diagnosis Related Groups) 기준의 실무 Q&A, 장기추적조사(10~30년), off-target 위험 평가, 품질관리(CMC) 심사가 반드시 동반되어야 한다.또 희귀 중증 질환의 경우에는 신속심사제도(Fast Track, Breakthrough Therapy, RMAT: Regenerative Medicine Advanced Therapy 등)의 문턱을 낮추어 혁신 치료의 조기 접근을 촉진하고 있다. Casgevy(겸상적혈구병·베타지중해성빈혈 대상 CRISPR 유전자편집 치료제)가 2023~2024년 최초로 허가를 획득한 배경도 이런 기조의 일환이라고 볼 수 있다.
2.2 유럽 EMA
EMA는 2025년 7월부터 첨단세포유전자치료제(ATMP: Advanced Therapy Medicinal Products) 통합 가이드라인을 전면 시행하고 있다. 임상·비임상·품질 등 전주기 세부 요건이 명확해졌으며, 특히 리스크 기반 관리와 소아·희소 질환 등 특수집단 적용 지침이 강화되었다. GMP(Good Manufacturing Practice) 및 RWE(Real World Evidence)의 활용, 인공지능·플랫폼 기반 새로운 기술 적용에 대한 가이드라인도 추가되는 등, 빠른 기술 발전에도 신속하게 대응하고 있다. 실제로, Zolgensma(척수성 근위축증 유전자치료제)와 같은 유전자치료제의 신속 허가 역시 품질·리스크 관리 기준의 혁신적 적용 결과라 할 수 있다.
2.3 일본 PMDA
일본 PMDA는 「재생의료 등 안전성 확보에 관한 법률(재생의료안전법)」과 「의약품·의료기기법(PMD Act)」을 2013년 세계 최초로 제정하여 Safety Act(안전성법)와 함께 줄기세포·세포치료·유전자치료 등 첨단치료제의 임상 및 품질, 안전성 확보를 위한 규제의 근간으로 하고 있다. 유전자치료제는 위험도가 최고(3급)로 분류되어 엄격한 안전성 관리와 장기추적조사 등을 필수 요건으로 하고 있다.
PMDA는 2025년 기준 in vivo 유전자편집 치료제에 대한 가이드라인과 고위험·조건부 승인 등에 대한 정책을 반복적으로 업데이트하고 있다. 신규 임상 진입 시 비교성 평가, 제조공정 관리, PMS(Post Marketing Surveillance: 장기추적조사) 체계 구축 등은 필수 조건이다. 일본에서 승인된 20개 재생의약품 중 9개는 유전자치료제이며, 4개는 조건부 승인 혹은 시한부 허가제로 환자 접근성과 리스크 관리를 병행하고 있다.
2.4 한국 식약처
식약처는 첨단재생바이오법(2020년)을 근간으로, 유전자치료제를 고위험으로 분류한 다중 규제 체계를 도입했다. 2024~2025년까지 품질 평가 가이드라인, 신속심사/패스트트랙, 맞춤형 심사 기준 등을 꾸준히 개정 중이며, 임상에서의 동의서 작성, 장기추적조사(최장 30년) 등을 강조하고 있다. mRNA 및 유전자편집 신기술의 현실 적용을 위한 국내외 가이드라인 최신화가 이루어지고 있고, 실제 혁신 치료제의 신속 허가 사례 및 조건부 관리 체계가 동시에 운영되고 있다.
식약처를 비롯한 세계의 주요 규제 기관의 유전자치료제에 대한 주요 규제 요구사항 및 핵심 쟁점은 아래 <표 1>과 같다.
<표 1> 유전자치료제 규제 요구사항 및 핵심 쟁점
분야 |
주요 규제 요구사항 |
핵심 쟁점·실무 이슈 |
비임상/임상 연구 |
작용기전, 표적·편집 효율, 오프타겟 변이, 독성 평가, 적정 모델, POC |
장기 안전성 검증 환자군·바이오마커 선정 데이터 신뢰성 임상 디자인 |
제조·품질관리 (CMC) |
제조공정 일관성, 순도, 안정성, 배치 재현성, GMP 기준, 공정검증 |
배치 간 동등성 입증 불순물 관리 글로벌 품질 표준화 |
시판 후 관리 |
장기추적(최대 30년) 환자등록·실사용데이터(RWD/RWE) 모니터링 |
예상치 못한 이상반응 삽입변이 추적 실질 효과 입증 데이터 투명성·리스크 관리 |
윤리·사회적 고려 |
동의서·개인정보·프라이버시 보호 데이터 투명·추적성 생식세포 편집 금지 |
환자 권리·윤리 심의 사회적 수용성·커뮤니케이션 국제 규범 동시 대응 |
2.5 유전자치료제 최신 논문 동향
FDA, EMA, PMDA, 식약처를 비롯한 글로벌 규제 동향은 최근 PubMed 등에서 발표된 연구·정책 트렌드를 통해 더 구체화하고 있다.
특히 2025년 국제 워크숍(FDA, 게이츠재단 등)에서는 CRISPR·CAR-T 유전자편집 치료제의 신속 개발과 ‘리스크-베네핏’ 균형에 대한 규제 프레임워크 혁신이 논의되었다(Biomedicines. 2025, Human Gene Therapy, 2024).
전 세계적으로 국제 규제 조화가 핵심 정책 의제로 부상하고 있으며, 저소득·중간소득 국가의 접근 확대, CAR-T세포·GMO 허가 사례, CRISPR 기반 치료제 실무(예: Casgevy FDA/EMA 승인) 등의 최신 임상·정책 사례가 공유되고 있다(Frontiers in Bioengineering and Biotechnology. 2025, Expert Review of Molecular Medicine. 2025).
이를 통해 각국 규제 기관은 안전성과 신속 허가, 국제 인정 기준을 동시에 높이고 있으며, 실제 임상 실무와 산업 전략에도 직접적 영향을 주고 있다고 할 수 있다.
2.6 국제 조화 및 협력
ICH, WHO, OECD 등 국제기구를 중심으로 표준화, 데이터 상호인정, 글로벌 임상시험 공동 심사 등 국제 규제 조화도 더욱 빠르게 진보 중이다. 각국 규제기관들이 점진적으로 실무 심사 방식의 유사성을 높이고, 혁신 치료제의 경우 글로벌 동시 개발 및 허가에 공동 대응하는 전환기가 도래하고 있다.
3. 주요 규제 요구사항 및 핵심 쟁점
유전자치료제는 기존 의약품과 확연히 다른 과학적·윤리적 특성을 갖고 있다. 따라서 규제기관들은 품질·안전성·윤리 측면의 세부 요구사항을 지속적으로 고도화하고 있다.
3.1 임상/비임상 연구
작용기전·타겟 유전자·편집 효율의 과학적 입증, 오프타겟 및 삽입 변이, 급·만성 독성 등 위험 평가를 필수적으로 수행해야 한다. Proof-of-Concept(POC) 연구, 적정 in vitro /in vivo 모델 사용, 장기 안전성의 선제적 확보가 강조되고 있다.
3.2 제조 및 품질관리(CMC)
벡터, 세포, 편집 효소의 제조공정 일관성, 순도, 안정성, 배치 간 재현성, GMP 기준 준수 등은 필수 요구사항이다. 제조공정의 변경, 시설 적격성, 오염 방지, 청정 밸리데이션(validation) 등도 관리 수준의 대폭 상향을 요구하고 있다.
특히 유전자치료제와 유전자편집 치료제의 개발·허가 과정에서 비교동등성 확보는 품질 및 글로벌 신뢰의 핵심이다. 제조공정 변경, 배치 전환 등에서 배치 간 품질·안정성·임상효과가 일관되게 유지되는지 입증해야 하며, 이는 각국 규제기관이 허가 심사 시 가장 엄격히 검증하는 항목이다. 특히 비교동등성 미흡은 상업화 실패 및 허가 거절로 이어질 수 있고, 반대로 우수한 데이터 준비는 국제 허가 전략의 성공적 기반이 된다.
<표 2> 비교동등성 관리의 실사례
사례 |
비교동등성 관리 |
결과 및 교훈 |
Glybera (uniQure) |
공정 변경 후 동등성 평가 미흡 품질변동 및 기준치 이상 |
생산 확대·상업적 허가 후 유럽시장 자진 철수 |
Casgevy (Vertex) |
임상 및 상업 배치간 동등성, 품질관리·안정성·장기추적 데이터 종합 제출 |
글로벌(FDA/EMA 등) 최초 허가된 CRISPR 편집치료제 |
규제기관에서는 모든 배치 변경·공정 변경 시 동등성 평가 계획을 미리 제출하고, 각 단계별 품질·임상·비임상 자료의 체계적 관리와 데이터 완결성 확보를 권고하고 있다.
<표 3> 비교동등성 단계별 가이드
개발 단계 |
비교동등성 체크포인트 |
비임상 |
제조공정·품질특성(CQA) 표준화, 분석법 적격성 평가 |
임상 |
임상배치·제조배치 품질·효능 비교, 변경시 추가 시험·바이오마커 분석 |
허가/시판 후 |
동등성 프로토콜 수립, 장기추적 조사(배치·변경 추적), 규제기관과 사전 소통 |
3.3 장기추적 및 시판 후 관리
유전자치료제는 시판 후 최대 30년까지 장기추적조사가 요구된다. 실사용데이터(RWD/RWE), 환자 등록, 유전자 삽입 변이, 암 발생 등 예상치 못한 이상반응의 실시간 모니터링 역시 심층 요구되고 있다.
3.4 윤리·사회적 고려와 환자 권리
임상 대상자 동의서(informed consent), 프라이버시 보호, 임상 데이터의 투명성·추적성, 생식세포 편집 금지 등 윤리 기준을 엄격히 관리하고 있다. 윤리위원회 심사, 사전 정보 제공, 사회적 허용 가능성에 대한 모니터링도 중요 쟁점이라 할 수 있다.
4. 실제 규제 사례 분석
4.1 허가 및 신속 심사 성공 사례
- Casgevy : 겸상적혈구병 치료를 위해 영국(2023), 미국(2023), 유럽(2024)에서 세계 최초로 허가된 CRISPR-Cas9 기반 유전자편집 치료제로, FDA의 신속심사와 과학적 근거 기반 CMC 자료, 장기추적 전략 등이 핵심 성공 요인으로 평가되고 있다.
- Zolgensma : AAV 기반 유전자치료제로, 허가 전 품질관리 보완 및 장기 안전성 검토를 거쳐 미국, 유럽, 일본, 한국 등에서 신속 승인되었다.
4.2 자료 보완·거절 및 이슈 사례
FDA, EMA는 한 글로벌 바이오텍의 유전자치료제에 대해, 품질관리 미흡(오염 우려, GMP 미충족) 및 임상자료 부족(코호트 수 부족, 적정 바이오마커 미도출)을 이유로 보완 요청 및 심사를 보류했다. 하기 <표 4>에서 유전자치료제의 성공, 실패 사례를 분석하였다.
<표 4> 유전자치료제의 성공, 실패 사례 분석
치료제 (기업) |
적응증 |
핵심기술 |
이유 |
시사점 |
|
성공사례 |
Casgevy (Vertex) |
겸상적혈구병(SCD), 베타지중해성빈혈(β-thalassemia) |
CRISPR-Cas9 |
강력한 과학적 근거, 오프타겟 효과 검증, 제조 공정 표준화, |
- 규제기관과의 초기·상시 소통 - 강력한 과학/임상적 근거 - 제조·품질·추적 전략의 철저함 - 신속 허가제도의 적극 활용 - 안전성과 유효성 입증이 승인의 가장 중요한 요소 |
Zolgensma (Novartis) |
척수성 근위축증(SMA) |
AAV기반 |
치명석 소아 질환 시장 선점, 선제적 제조 품질 관리 개선, |
||
실패사례 |
Elevidys (Sarepta) |
듀센 근이영양증(DMD) |
AAV기반 |
임상 중 추가 사망 사례 보고, |
- 제조 및 품질 관리(CMC)의 신뢰성 미확보 - 안정성에 대한 우려 - 상업적 성공의 불확실성도 중요한 문제 |
Glybera (uniQure) |
LPLD(지단백질분해효소결핍증) | AAV1기반 |
상업적 실패(높은 가격, 적은 환자 수)로 인해 자진 시장 철수 |
||
UX111 (Untragenyx) |
산필리포증후군 |
AAV기반 |
임상 데이터에는 문제 없었지만 제조 공정에 대한 |
4.3 신기술(유전자편집 등)에 대한 규제 대응과 개발 현황
CRISPR·프라임 에디터·베이스 에디터 등 신기술 적용 시, 기존 벡터·세포치료제와 다른 오프타겟 검증·데이터 투명성 요구가 현저히 상향조정되고 있다. 최근 식약처, FDA 모두 mRNA·유전자편집 치료제 품질 평가의 글로벌 최초/최신 가이드라인을 최근 3년 사이 지속적으로 개정·공표하며, 신기술의 규제 진입을 지원하고 있다.
5. 향후 전망 및 규제 대응 전략
5.1 정책 및 제도화 개선 방향
규제의 예측 가능성, 투명성, 국제 조화가 더욱 중요해질 전망이다. 디지털전환, 실시간 데이터 관리, RWE 인증 등 첨단 플랫폼 기반의 규제 혁신이 가속화될 것으로예상된다.
5.2 기업·연구자 실무 대응 가이드
유전자편집 치료제 개발 기업 및 연구자들은 규제기관과의 사전 소통(Pre-IND 등) 및 데이터 검증을 강화해야 한다. 새로운 첨단 치료제 생산을 위한 플랫폼 GMP를 구축하고, 비교동등성 관리 및 각 단계별 전략을 품질관리의 핵심으로 삼아, 공정 변경·배치간 품질 변화 시마다 동등성을 입증해야 한다. 또 그에 대한 문서화, 장기추적·실효성 평가까지 수행하며 규제기관과 적극적이고 선제적으로 소통해야 한다.
데이터 투명성 확보, IRB/윤리위원회와의 적극적 협업 또한 필요하다. 그리고 글로벌 동시 개발·허가를 위한 다국가 자료 표준화 및 국제 인증 취득 등도 능동적인 규제 대응 전략으로 꼽힐 수 있다.
5.3 글로벌 스탠다드 확보와 국내 산업 발전
한국 등 주요 국가들의 신속심사, 패스트트랙·맞춤형 심사 제도의 적극적인 활용, 국내외 인재 및 규제과학 전문가 육성, 빅데이터·AI 기반 품질관리 혁신이 중요한 과제로 부상할 것이다.
6. 결론
유전자치료제는 의약산업과 의료 패러다임을 근본적으로 변화시키고 있다. 혁신과 위험은 본질적으로 함께할 수밖에 없으며, 규제과학은 이 둘의 균형을 통해 환자 안전과 신뢰성, 산업의 지속 가능한 발전을 견인하는 핵심 역할을 하고 있다.
각국은 현재 동태적이고 과학적이며 예측할 수 있는 규제 체계를 구축 중이며, 기업 및 연구 기관도 적극적이고 투명한 규제 대응 역량을 갖출 필요가 있다. 글로벌 경쟁과 협업, 규제 스탠다드를 선점하는 것이 미래 첨단 의약산업을 좌우할 중요한 변수임을 다시금 강조하는 바다.
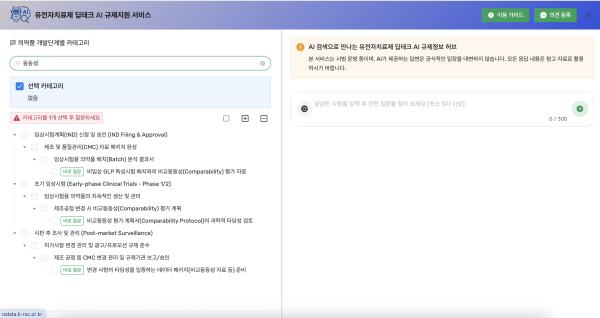
[참고: 규제과학센터 AI 규제지원 서비스/사용법 안내]
한국 규제과학센터에서는 유전자편집 치료제 등 고도의 기술이 요구되는 첨단의약품 개발을 지원하기 위해 "유전자치료제 딥테크 AI 규제지원 서비스"를 시범 운영하고 있다.
이 서비스는 유전자편집 치료제 개발 전 주기를 6개의 단계 (①비임상 연구 ②IND 신청 ③초기 임상 ④후기 임상 ⑤품목허가 신청 ⑥시판 후 조사)로 나누고, 각 단계를 세 분류(대분류→중분류→소분류)로, 총 757개 세부 카테고리로 구분한다.
연구개발자와 실무자는 각 단계 및 카테고리별로 규제기관 실무 관점의 질문을 AI로 자동 생성하고, 질문을 선택하면 AI가 최신 규제현황을 반영한 실무형 답변을 제공하게 된다.
○ 사용법 안내
① 접속 : rsdata.k-rsc.or.kr 로그인 (ID : krsc, PW : krsc1234)
② 단계/카테고리 선택 또는 검색어 입력
∘ 개발 단계별 카테고리를 클릭하거나
∘ 원하는 키워드(예: "동등성") 검색 후 관련 카테고리 선택
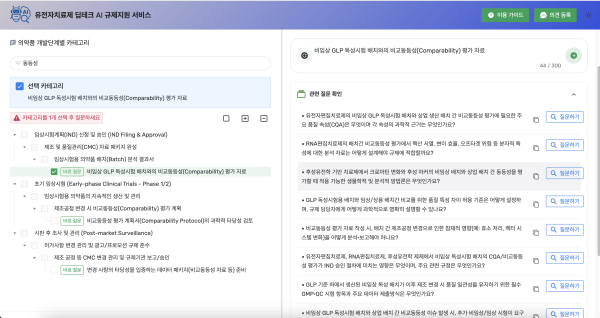
③ 질문 생성 및 답변 확인
∘ 선택한 카테고리에서 '질문 생성' 클릭
∘ 생성된 질문 중 궁금한 항목을 선택하면 AI가 규제 대응 답변을 즉시 안내
④ 예시: "동등성" 검색 → 해당 카테고리에서 질문 자동 생성 → 질문 클릭 → 규제 관련 실무 답변 획득
○ 주요 특징
- 질문 및 답변 생성 모두 AI 기반으로 신속 처리
- 757개 카테고리로 개발 단계별 맞춤형 규제 대응 준비 가능
- 최신 국내외 의약품 규제 현황 실시간 반영
- 연구자의 실무적 궁금증을 규제기관 실무자 답변 방식으로 안내
- 현재 시범운영 중으로, 사용자 피드백 적극 반영하여 서비스 개선 계획
"유전자치료제 딥테크 AI 규제지원 서비스"를 활용함으로써 유전자치료제 개발 전 과정에서 규제 대응 전략 마련 및 최신 규제자료 확인이 훨씬 쉽고 체계적으로 이루어지기를 기대하고 있다. 연구개발자, 실무자 모두 원하는 규제 정보를 AI와 함께 손쉽게 도출할 수 있을 것이다.
참고문헌
1. FDA. “Considerations for the Design of Early-Phase Clinical Trials of Cellular and Gene Therapy Products: Guidance for Industry.”FDA, 2023, 2024년 및 2025년 draft 가이드라인, Cellular & Gene TherapyGuidance FAQ.
2. FDA. “Regulation of Human Cells, Tissues, and Cellular and Tissue-Based Products (HCT/P's). ”FDA official notices and pressreleases, 2024~2025.
3. FDA. “Long Term Follow-up After Administration of Human Gene Therapy Products,” 2020.
4. Vertex Pharmaceuticals. “CASGEVY: First Approval. ”Press Release, 2023, 2024.
5. EMA. “Guideline on quality, non-clinical and clinical aspects of medicinal products containing genetically modified cells. ”(ATMP guideline, EMA/CAT/571134/2023), 적용 2025년 7월1일부.
6. EMA. “Advanced Therapy Medicinal Products Regulation and Guidance.” Official website, 2024~2025.
7. EMA. Zolgensma Assessment Report, EPAR, 2019; 심사 보도자료(2020~2024).
8. PMDA, MHLW. “Guidelines for the Clinical Trials of Gene Therapy Products, ”2021, 2025년 업데이트 draft.
9. PMDA. 고위험 재생의약품/유전자치료제 분류 및 조건부 승인 가이드라인, 2023~2025.
10. PMDA. “Pharmaceuticals and Medical Devices Act,” 2023, 2025.
11. PMDA. 일본 내 실사례 발표자료, BioJapan 2024/25.
12. MFDS(식약처). “첨단바이오의약품 품질평가 가이드라인, ”2024~2025, 한글, 영문(개정).
13. MFDS(식품의약품안전처). 첨단재생바이오법 시행령/시행규칙 및 관련 해설서, 2024~2025년.
14 MFDS 보도자료. “유전자치료제·mRNA 등 신기술 기반 품질평가 가이드라인 국제조화 현황,” 2023~2024.
15. ICH. “Efficacy Guidelines, Efficacy of Gene Therapy Products,”2024.
16. WHO. “Global Regulatory Harmonization for Genome Editing Technologies,”2024.
17. FDA. “Postmarketing Requirements for Cellular and Gene Therapy Products, ”Guidance, 2024.
18. Jadlowsky JK, Hexner EO. Regulatory Considerations for Genome-Edited T-cell Therapies. Human Gene Therapy, 2024, 35(9): 620–630. https://doi.org/10.1089/hum.2024.033
19. Olaghere J, Williams DA, Farrar J, Büning H, Calhoun C, Ho T, et al. Scientific Advancements in Gene Therapies: Opportunities for Global Regulatory Convergence.Biomedicines, 2025, 13(3):758. https://doi.org/10.3390/biomedicines13030758
20. Fernández Ríos D, Quintana SA, Gómez Paniagua P, Arrúa AA, Brozón GR, Bertoni Hicar MS, Castro Alegría A, Goberna MF. Regulatory challenges and global trade implications of genome editing. Frontiers in Bioengineering and Biotechnology, 2025, 13:1609110. https://doi.org/10.3389/fbioe.2025.1609110
21. Cetin B, Erendor F, Eksi YE, Sanlioglu AD, Sanlioglu S. Advancing CRISPR genome editing into gene therapy clinical trials: progress and future prospects. Expert Review of Molecular Medicine, 2025 Mar 31; 27:e16. https://doi.org/10.1017/erm.2025.10
* 본 기고문은 과학기술정보통신부에서 시행한 「유전자편집·제어·복원기반기술개발사업」수행의 일환으로 작성되었습니다.
* 본 내용은 유전체편집연구지원사무국(GERC)의 의견과 다를 수 있음을 밝힙니다.
* 인용, 발표하실 때에는 반드시 출처를 밝혀주시기 바랍니다.