과학과 자본, 혁신기술 도입 이야기 : 유전자편집 치료제
이승우 상무이사, 데브시스터즈벤처스㈜
1. 유전자편집 기술의 산업적 태동
지금으로부터 10여년 전 유전자편집 기술을 선도하고 있는 많은 기업들이 태동하였다. 우리나라의 툴젠(Toolgen)을 비롯하여 스위스의 크리스퍼 테라퓨틱스(CRISPR Therapeutics, 이하 크리스퍼), 미국의 인텔리아 테라퓨틱스(Intellia Therapeutics, 이하 인텔리아) 및 에디타스 메디신(Editas Medicine, 이하 에디타스)이 그들이다.
2014년 4월, 크리스퍼는 미국의 바이오 전문 VC인 버산트 벤쳐스(Versant Ventures)로부터 2,500만 달러의 Series A 투자를 유치하며 개발에 박차를 가했다. 또한 인텔리아는 노바티스(Norvatis), 에디타스는 써드락 벤처스(Thrid Rock Ventures)로부터 시드투자를 유치하며 경쟁에 참여하였다.
CRISPR-Cas9에 대한 특허 경쟁이 심화되고 있을 때, 해당 기술 연구 분야의 선도 연구자였던 제니퍼 다우드나(Jennifer Doudna)와 엠마뉴엘 샤르팡티에(Emmanuel Charpentier) 그리고 펭 장(Feng Zhang)은 각각 다른 회사에 자신의 기술들에 대한 라이선스를 부여하였다. 다우드나는 인텔리아와, 샤르팡티에는 크리스퍼와, 그리고 장은 에디타스와 특허 라이선스 계약을 맺으며 이들 세 회사는 수억 달러의 투자금을 유치하고 마치 경주마처럼 신약개발을 위해 달려나갔다.
2020년 다우드나가 노벨 화학상을 수상하면서 유전자편집 기술에 대한 전 세계의 이목이 집중됐고 스티브 잡스(Steve Jobs), 일론 머스크(Elon Musk) 등의 전기 작가로 유명한 월터 아이작슨(Walter Isaacson)이 다우드나의 자서전을 펴내며 많은 사람들의 관심을 받게 된다. 다우드나의 전기를 다룬 ‘The Code Breaker’에서는 여성 과학자의 성장기뿐 아니라 유전자편집 기술을 발전시키기 위한 전 세계의 연구진과 산업계의 엄청난 노력이 박진감 넘치게 묘사되었다.
2. 혁신의 선두를 차지하기 위한 치열한 경쟁 : 특허와 임상
한편 2012년 CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)를 이용한 유전자편집 특허의 우선권이 발효된 이래 CRISPR 관련 특허분쟁은 여전히 진행 중이다. 더욱이 2023년에 CRISPR를 이용한 첫 번째 치료제가 승인되며 CRISPR 기술 관련 특허 침해 소송은 현실화됐고, 현재 임상 단계의 다수 CRISPR 치료제를 감안하면 미래의 특허분쟁 역시 쉬이 끝날 조짐은 보이지 않는다.
인터넷을 비롯, 모든 것이 네트워크로 연결된 초연결사회(Hyper-connected Society)에서 살아가는 우리가 특정 1인을 선택해서 발명의 고유성을 인정해주기도 어려울 뿐만 아니라, 많은 협업 속에서 발전하는 현대 과학의 특성을 고려하면 누군가를 특정해야 하는 노벨상 수상자 선정도 쉽지 않을 것이라는 생각을 하게 되었다.
약 10여 년에 걸쳐 각각의 회사들은 모두 나스닥(Nasdaq)에 상장하며 연구개발에 필요한 연료를 채웠고 에디타스가 2016년 2월, 인텔리아는 2016년 5월, 그리고 크리스퍼는 2016년 10월에 기업공개(IPO)를 마치며 마치 경주를 하듯 연구개발을 진행하였다.
Figure 1. Intellia Therapeutics의 IPO Opening Bell Ceremony (출처: Nasdaq)
인텔리아, 에디타스, 크리스퍼 등의 회사들은 레베르 선천성 흑암시(LCA, Leber Congenital Amaurosis) 치료제 EDIT-101, 겸상적혈구질환(SCD, Sickle-cell Disease) 치료제 EDIT-301 및 CTX001, 트랜스티레틴 아밀로이드증(ATTR, Transthyretin Amyloidosis) 치료제 NTLA-2001 등 희귀난치성 질환 치료제 개발에 박차를 가했고 2016년부터 임상에 들어가기 시작했다.
그리고 드디어 지난해, 우리 모두가 아는 것처럼 세계 최초의 유전자편집 치료제가 탄생하게 된다.
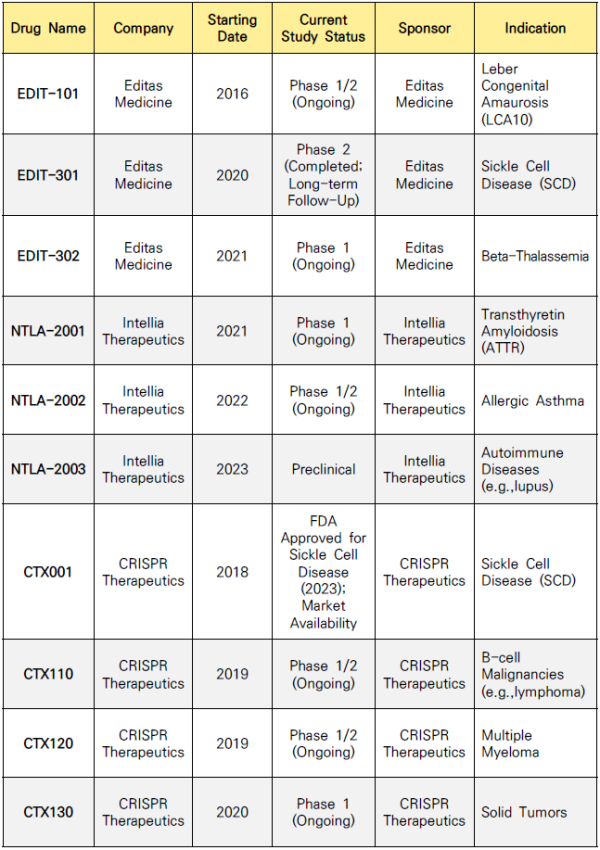
Figure 2. Current Trials Status of Gene-Editing Therapeutics
3. 혁신의 결과 : 유전자편집 치료제의 첫 FDA 승인
많은 과학자와 산업계의 관심과 노력 속에 개발돼온 유전자편집 기술은 2023년 드디어 첫 번째 혁신을 이루어낸다. 크리스퍼 테라퓨틱스와 미국 제약사 버텍스 파마슈티컬스(Vertex Pharmaceuticals)가 공동 개발한 유전자가위 치료제 ‘카스게비(Casgevy, 성분 엑사감글로젠 오토템셀)’의 규제승인이 그것이다.
카스게비는 11월 16일 영국 의약품청(MHRA)으로부터 SCD 및 수혈의존성 베타지중해 빈혈(TDT, transfusion dependent thalassaemia) 치료제로 전세계 최초 승인됐다. 이어 12월 8일(현지시간) 미국 식품의약국(FDA)에서도 카스게비를 SCD 치료제로 승인했고 동시에 블루버드 바이오(Bluebird Bio)가 개발한 유전자 치료제 ‘리프제니아(Lyfgenia, 성분 로보티베글로진 오토템셀)’도 함께 승인했다.
카스게비는 올해 초 FDA로부터 TDT 치료제로 적응증 추가 승인도 받은 바 있다.
최초의 유전자편집 기술이 적용된 신약의 적응증인 SCD는 11번 염색체상에 존재하는 헤모글로빈 유전자 염기서열 1개가 바뀌어 발생하는, 상염색체 중간 유전질환이다. 적혈구 모양이 낫처럼 변형돼 산소 운반 능력이 떨어짐에 따라 환자들은 만성빈혈을 겪게 되고 겸상적혈구가 혈관을 막아 온 몸의 다양한 부위에 허혈 증세가 나타난다.
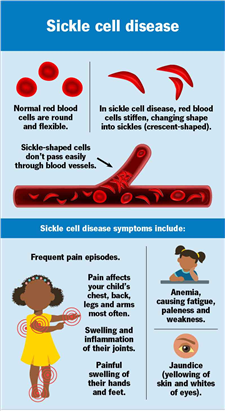
Figure 3. Overview of Sickle Cell Disease (출처: www.clevelandcclinic.org)
유전성 질환인 SCD는 부모로부터 유전되는 겸상적혈구의 종류에 따라 HbSS, HbSC, HBS beta-thalasemmia로 구분되며 드물게 HbSD, HbSE, HbSO가 나타날 수 있다. 각 유형에 따라 임상 증상의 중증도가 달라지며 환자의 삶의 질은 크게 차이가 나게 된다.
SCD는 생후 첫 해에 증상이 나타나기 시작하며 모든 장기에 영향을 미친다. 증상 및 합병증은 사람마다 다르지만 빈혈, 뇌졸중, 간질, 신부전, 다양한 장기의 손상 등이 일반적이다.
이러한 삶의 질의 저하와 치명적인 합병증에도 불구하고 기존의 치료법은 증상 완화 및 합병증 예방에만 초점이 맞춰져 있었다. 빈혈을 치료하기 위해 엽산을 복용하거나 수혈을 하고, 통증을 경감하기 위해 진통제나 마약성 진통제 사용, 그리고 감염 예방을 위해 항생제 치료를 해왔다.
물론 완치를 목적으로 골수이식도 시행하기도 하지만 골수이식이 가능한 가족을 가진 환자는 단 15%에 지나지 않고 가족이 없는 환자의 10~12%는 기증자를 통한 골수이식이 가능하다.결국 전체 SCD 환자의 25%만이 골수이식이 가능한 후보군으로 분류된다는 뜻이다.
미국의 경우 약 10만 명의 중증 증상 환자가 있다고 파악되며 특히 흑인들의 경우 365명 중 1명꼴로 발생할 정도로 생각보다 많은 유병자가 분포하고 있다.
흑인들의 유병률이 높은 배경에 대해 진화론적 고찰을 해보자면, 말라리아가 창궐하는 아프리카의 특색 파악부터 시작해야 한다. 말라리아에 감염된 사람은 말라리아 원충이 적혈구 속 헤모글로빈을 먹어 치우며 적혈구를 파괴하여 사망에 이르게 한다. 하지만 겸상적혈구를 가진 사람은 말라리아 원충이 혈구 내에 들어가더라도 대사 장애로 인해 말라리아가 생존하지 못하고 증상이 상대적으로 약하게 지나간다. 때문에 아프리카 지역의 흑인들이 유병자의 다수를 차지하게 된 것이다.
실제로 아프리카계 흑인이 많은 미국의 스포츠 및 연예계의 유명인들이 해당 질환을 앓고 있음을 밝히기도 했고 현재 보존적 치료를 하며 살아가고 있다.
이런 상황에서 유전자편집 치료제인 카스게비는 BCL11A 유전자를 Cas9으로 제거, 태아 때의 헤모글로빈을 지속적으로 생산하여 겸상적혈구의 양을 줄임으로써 증상을 영구적으로 완화시키는 원리를 가지고 개발되었다.
유전자편집 치료 과정은 약 8~12개월의 기간이 소요된다. 우선 겸상적혈구 수를 최소화하기 위해 수혈을 실시해 줄기세포를 수집한 후, 그것을 처리시설로 보내 CRISPR 기술로써 환자의 줄기세포를 편집한다. 이 과정에서 환자들은 선행 화학요법을 통해 결함이 있는 기존의 헤모글로빈 조혈모세포를 제거하고 신체가 새로운 헤모글로빈을 거부하지 않도록 준비하게 된다. 유전자편집된 줄기세포를 이식받은 환자는 이식된 세포가 자리잡을 때까지 한 달 정도의 입원 기간 동안 면역억제 약물을 복용하며 의료진의 관찰이 수반된다.
4. 기술의 혁신이 환자의 혜택으로 돌아오기 위한 마지막 과제
골수이식보다 훨씬 안전한 과정을 통해 완치에 이를 수 있는 치료제가 탄생했지만 환자들이 실제 혜택을 누릴 수 있기까지는 아직도 많은 관문들이 남아있다. 약 1년간의 치료 기간, 세포 처리 및 치료 기간 중 들어가는 비용 등의 치료비용은 유전자편집 치료에 대한 환자의 접근을 어렵게 만드는 장애물이 되고 있다. 치료비용의 경우 미국 기준, 환자당 약 2~3백만 달러 이상의 비용이 들 것으로 추산되는 실정이다.
단, 이 치료비용은 개발비 및 실 치료비 기반이 아닌, 환자의 평생치료에 사용될 비용인 가치 기반 가격 책정(Value-Based Pricing, VBP)을 통해 추산된 가격이다. 현재 우리나라 건강보험이 채택하고 있는 VBP는 신약을 사용하기 위해 지불할 금액을 소비자의 기대 가치에 기반해 산정하는 방식이다. 질병의 경중에 따라 가격을 결정하는 VBP에서 더 나아가 최근에는 하나의 약제가 가진 여러 적응증에 따라 가격이 결정되는 적응증별 약가 책정(Indication-Base Pricing, IBP) 도입의 필요성이 제기되고 있다.
이런 상황에서 세계 최초로 카스게비를 허가한 영국에서는 2024년 8월 8일 카스게비에 대해 SCD 환자를 대상으로 급여 적용 관련 협의를 하였다고 밝히며 다른 국가들에게도 방향성을 제시해줄 수 있는 기준을 만들어 나가고 있다.
이렇듯 유전자 치료제의 허들인 치료비용 등의 이슈 해결을 위해 다우드나는 자신이 2017년 설립한 유전체 혁신 연구소(Innovative Genomics Institute, IGI)를 통해 지난해 ‘Making Genetic Therapies Affordable and Accessible’라는 보고서를 펴내기도 했다. 해당 보고서는 자금조달 및 제조방식 개선, 대체가능한 IP 라이선스 접근법 등을 통해 현재의 유전 의약품 비용을 10배 이상 줄이기 위한 전략을 제시하였다.
카스게비 출시 이후의 성적표에 대한 평가는 차차 이루어지겠지만 개발사인 크리스퍼의 성공적인 상장 및 현재 약 40억 달러에 이르는 시가총액 등을 미뤄보건대 지속성장 가능한 혁신이 인정받았다고 볼 수 있겠다.
이런 사례를 기반으로 많은 테세라 테라퓨틱스(Tessera Therapeutics), 맘모스 바이오사이언스(Mammoth Biosciences), 아버 바이오테크놀로지(Arbor Biotechnologies) 등 CRISPR 유전자편집 기술을 사용해 치료제를 개발하고 있는 기업들에 대해 많은 투자가 이뤄지고 있다.
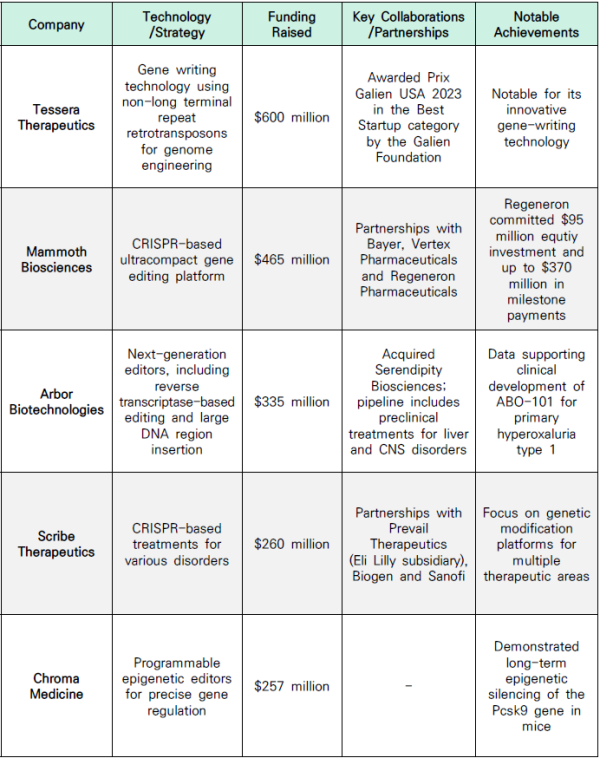
Figure 4. Recent Investments of Gene-editing (출처: www.genengnews.com)
유전자편집 기술 및 유전자가위 치료제에 대한 관심 제고와 지속적인 혁신을 이루기 위해서는 많은 고민이 필요하다. 연구개발뿐 아니라 생산공정의 혁신, 체외조작(ex vivo)이 아닌 체내조작(in vivo) 방식 개선, 실제 치료시의 비용 개선, 제약사 및 보험사 등과의 사회적 논의가 이루어져야 하는 것이다. 또한 정부와 민간이 같이 주도하여 이런 혁신 기술을 합리적인 가격에 도입하여 환자의 혜택을 제고하고, 개발사로 하여금 지속적인 혁신 개발을 위한 도전을 독려할 수 있는 방법에 대한 고찰과 실행이 수반되어야 한다.
아직도 수많은 난치질환을 앓고 있는 환자들은 SCD처럼 치료법이 없는 채로 평생 고통과 불안 속에서 살아가고 있다. 치료제 개발 및 적용을 위해 과학자들, 임상의사들 및 수많은 기관들 또한 끊임없이 노력하고 있다. 기술의 혁신속도가 빨라지는 만큼 이런 노력에 대한 합리적 보상과 더불어 경제적인 관점에서의 제품 도입 및 가격 책정에 대한 논의의 시작은 난치질환자들의 희망을 지킬 수 있는 첫걸음이 될 것이다.
* 본 기고문은 과학기술정보통신부에서 시행한 「유전자편집·제어·복원기반기술개발사업」수행의 일환으로 작성되었습니다.
* 본 내용은 유전체편집연구지원사무국(GERC)의 의견과 다를 수 있음을 밝힙니다.
* 인용, 발표하실 때에는 반드시 출처를 밝혀주시기 바랍니다.