유전자편집 치료제 개발 동향
(Landscape for the development of gene-editing therapy)
김용삼 ㈜진코어 대표이사 / 한국생명공학연구원 책임연구원
1. 초기 유전자편집 치료제의 개발 사례
□ 최초의 유전자가위 기술이 소개된 2002년 이후 초기 유전자편집 치료제 개발은 Zinc Finger Nuclease(ZFN) 기술을 적용하여 시도됨. 관련 기술의 라이센스를 보유하고 있던 상가모 테라퓨틱스(Sangamo Therapeutics)에 의해 주도되었으며 크게 체외(ex vivo) 영역과 체내(in vivo) 영역으로 나누어져 진행됨
□ ex vivo 영역에서 개발이 진행되었던 대표적인 치료제는 SB-728-T라는 물질명을 갖는 HIV 치료제였음. HIV 환자에서 T세포 추출 후 ZFN을 전달하여 CCR5를 넉아웃(knock out)한 후 이를 다시 환자의 몸에 투여하는 자가치료 방식임. CCR5는 HIV의 면역세포 침입 관문 역할을 하는 단백질로 CCR(-) T세포의 경우 HIV에 저항성을 갖는 특징을 활용함
□ 그 후 베를린 환자의 사례*를 배경 삼아 조혈모세포의 유전자편집을 수행하면 영구적으로 HIV 면역력이 획득됨이 예견되어 조혈모세포 편집 기반의 임상이 추진됨
* 베를린 환자의 사례: AML과 AIDS를 동시에 갖고 있던 Timothy Ray Brown이 CCR5(-) 공여자로부터 조혈모세포를 이식받은 후 AIDS에 대한 면역을 갖게 됨 |
□ ZFN을 adenovirus나 mRNA의 전기영동 방법으로 전달하여 다양한 치료 효과의 최적화를 노렸으나 장기추적 연구만 수행된 채 상업화로 이어지지는 못함
□ in vivo 영역에서는 ZFN과 기능성 유전자를 담은 AAV 전달체를 간에 전달하여 대사유전 질환을 앓고 있는 환자에게 유전자보충치료 개발 임상이 행해짐. α-Gal A 유전자 전달 기반(ST-920)의 Fabry 질환에 대해 임상연구까지 수행됐으나 이 또한 만족스럽지 못한 효율로 인해 종료되었음
□ 비교적 유전자 크기가 작은 ZFN과는 달리 Transcription activator-like effector nucleases(TALEN)은 총 페이로드의 크기가 커 in vivo 치료제 적용이 쉽지 않음. 따라서 TALEN의 특허권을 보유한 셀렉티스(Cellectis), 셀렉티스로부터 기술을 라이센싱한 알로젠 테라퓨틱스(Allogene Therapeutics) 및 세르비에(Institut de Recherches Internationales Servier)에 의해 ex vivo 치료제 개발에 활용되었음
□ 이들 치료제는 TCR이나 MHC 유전자 제거를 통해 동종(allogeneic) T세포 기반의 암 치료가 목적으로 일부는 현재에도 임상이 진행되고 있음. 하지만 다양한 동종 CAR-T 치료제들이 동시 개발되고 있어 이들 치료제가 경쟁력을 확보하는 데 어려움이 있을 것으로 생각됨
2. 크리스퍼(CRISPR) 유전자가위의 개발
□ 미국 Jennifer Doudna 교수와 Emmanuelle Charpentier 박사의 생화학적 실험이 2012년 Science에 소개되고[1], 이듬해 여러 연구그룹에 의해 진핵세포에서의 편집능이 증명되면서[2][3][4] CRISPR 기술은 유전자편집의 혁명을 일으킬 것으로 예견되었음
□ ZFN이나 TALEN 대비 CRISPR의 장점은 높은 효율성, Cas 및 guide RNA의 엔지니어링을 통한 효율의 최적화 및 염기교정, 프라임 에디팅(prime editing), CRISPR-a/i 등 다양한 기술로의 확장 등임. 또한, 무엇보다 손쉽게 다양한 유전자를 편집할 수 있어 유전자편집의 민주화를 이루었다는 평가를 받음
□ 2013년 이후 에디타스 메디신(Editas Medicine), 크리스퍼 테라퓨틱스(CRISPR Therapeutics), 인텔리아 테라퓨틱스(Intellia Therapeutics) 등, CRISPR-Cas9 기반 바이오텍 기업들이 창업되면서 본격적인 CRISPR 기반 유전자치료제 개발 경쟁이 시작됨
□ 특히 크리스퍼 테라퓨틱스가 ex vivo 기반의 지중해성빈혈증(beta-thalassemia) 및 겸상적혈구빈혈증(sickle cell disease) 치료제를 개발해 가장 먼저 상업화에 성공하면서 CRISPR 기술이 소개된 지 10년 만에 최초의 치료제를 상용화하는 기염을 토해냄
□ 이중나선 DNA 절단 기반의 CRISPR-Cas9 와 달리 DNA를 자르지 않고 유전자를 편집할 수 있는 염기교정 기술, 프라임 에디팅 기술이 개발되면서 이 기술의 특허권을 보유한 빔 테라퓨틱스(Beam Therapeutics)와 프라임 메디신(Prime Medicine)의 나스닥 상장과 함께 다양한 유전자가위 기반 치료제 개발이 본격화되고 있음
3. 최초의 유전자편집 치료제 – 카스게비(Casgevy)
□ 노벨상 수상자인 Charpentier 박사는 2013년 크리스퍼 테라퓨틱스를 창업하여 CRISPR-Cas9 기술 기반 치료제 개발을 시작함. 스위스에 본사를 두고 보스톤, 샌프란시스코, 영국 등에 사업소를 열어 유전질환 치료제를 개발하고 있음
□ 크리스퍼 테라퓨틱스는 버텍스 파마슈티컬스(Vertex Pharmaceuticals)와의 전략적 연구 제휴의 첫 프로그램으로 겸상적혈구빈혈증과 지중해성빈혈증에 대한 ex vivo 치료제 개발을 시작함
□ 2020년 5월 FDA로부터 희귀의약품(orphan drug) 지정을 받았고 임상 3상에서 우수한 효능 및 안전성을 입증하여 영국, 미국에서 승인을 받았으며 유럽 EMA의 승인도 예상됨
□ 겸상적혈구빈혈증과 지중해성빈혈증은 헤모글로빈을 구성하는 베타글로빈(beta-globin) 유전자의 결핍 또는 이상으로부터 기인함. 서아프리카 및 지중해 연안 혈통에서 베타글로빈 유전자의 변이가 높은 비율로 나타나고 있으며 해당 변이를 갖는 환자들은 악성빈혈, 혈관 막힘 및 다양한 감염 등의 증상들을 나타냄
□ 크리스퍼 테라퓨틱스와 버텍스 파마슈티컬스는 이 치료제 개발에 있어 기존에 널리 알려진 헤모글로빈 발달생물학적 지식을 차용함. 엄마의 배 속에 있을 때 태아는 베타글로빈 대신 감마글로빈(gamma-globin) 유전자를 발현하여 α2γ2 형태의 헤모글로빈을 형성함 <그림 1>
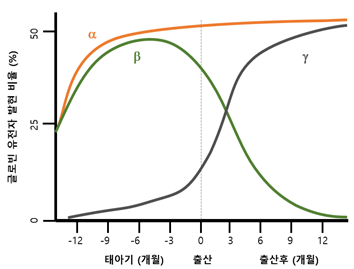
<그림 1> 출산 전후의 글로빈 유전자발현 변화 양상
출처: 필자 제공
□ 하지만 생후 성장하면서 감마글로빈 유전자 발현이 억제되고 베타글로빈 유전자가 이를 대신하게 되는데 이때 감마글로빈 유전자 발현을 억제하는 핵심 유전자가 BCL11A임. 즉 BCL11A에 의한 억제 메커니즘을 통제하면 감마글로빈 유전자 발현을 재생할 수 있게 되어 베타글로빈 이상이 있는 어린이 또는 성인에게 α2γ2 형태의 헤모글로빈을 공급할 수 있게 됨
□ 이러한 생물학적 지식에 기반하여 BCL11A의 인핸서(enhancer) 부위를 CRISPR-Cas9으로 제거함으로써 태아형 감마글로빈의 발현량을 증가시키는 전략이 이 약물의 핵심 기전임. 이를 위해 환자의 조혈모세포를 체외에서 유전자편집한 후 이를 다시 골수에 생착시키는 자가형(autologous) 체외 유전자치료 방식을 택하게 됨. 엑사셀(Exa-cel)이라고 알려진 이 약물의 정식 명칭은 ‘Exagamglogene Autotemcel’로 앞서 기술한 원리를 모두 담고 있음 <그림 2>
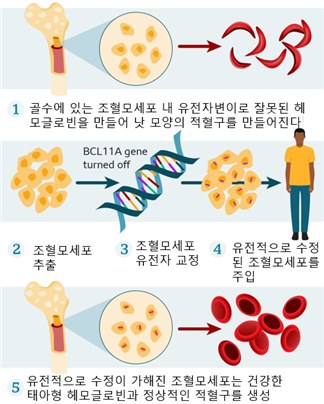
<그림 2> 카스게비(Exagamglogene Autotemcel)의 치료원리
출처: BBC
□ 엑사셀은 임상 3상에서 지중해성빈혈증 환자 44명의 수혈 기간을 최대 36.2개월로 늘렸고 1회 투약으로 추가 수혈 없이 최대 3년간 약효가 유지되는 것을 입증함. 또 겸상적혈구빈혈증 환자 31명은 엑사셀 투약 후 최대 32.2개월까지 혈관 폐쇄 증상을 겪지 않는 비교적 놀라운 결과를 나타냄
□ 오프타겟(off target)에 대한 안전성의 이슈로 15년의 추적관찰이 요구됐으나 이는 비단 엑사셀만의 이슈는 아니며 FDA 가이드라인에서 모든 유전자편집 치료제에 대해 15년간 추적관찰 하도록 요구하고 있는 사항임
□ 카스게비의 상업화에 따른 매출은 연간 22~39억 달러에 이를 것으로 전망됨[5]. 다만 염기교정 및 다른 유전자가위 기술을 활용한 동일한 치료제가 임상시험을 진행하고 있어 향후 유전자편집 치료제 시장의 경쟁은 더욱 치열해질 것으로 생각됨
4. 항암면역세포 치료법과의 접점
□ 다양한 치료법이 존재함에도 암의 이질성 및 높은 재발률로 인해 난치질환 중의 하나로 여겨지고 있는 혈액암의 치료에 혁명을 가져다준 기술이 바로 CAR-T 치료제임. CAR-T 치료제는 환자의 인체에 존재하는 T세포를 분리한 후 주로 바이러스를 이용하여 CAR(chimeric antigen receptor)라는 인공 유전자를 전달하여 암세포 식별 및 살상 능력을 높인 치료방식임
□ 노바티스(Novartis)의 킴리아(Kymriah)를 필두로 길리어드 사이언스(Gilead Sciences)의 예스카타(Yescarta)와 테카투스(Tecartus), BMS(Bristol Myers Squibb)의 브레얀지(Breyanzi)와 아베크마(Abecma), J&J(Johnson & Johnson)의 카빅티(Carvykti) 등의 다양한 CAR-T 치료제들이 승인을 받으면서 암 치료의 주요 모달리티로 자리매김하였으며 많은 생명공학 기업들이 보다 우수한 치료제를 개발하고자 경쟁하고 있음
□ 이들 치료제의 완전 관해율이 50~80%대에 달하는 등 기존의 치료약물과 비교하여 효과 면에서 매우 우수한 결과를 보임
□ 하지만 현재 승인을 받은 모든 치료제는 자가치료(autologous therapy) 방식이라는 한계를 가지고 있음. 환자의 몸에서 T세포를 분리하여 치료제를 만들어야 하므로 환자의 불편함, 높은 치료비용, 치료제 제작까지의 긴 시간, 소수의 제작시설과 자가방식으로 인한 대량생산의 제한 등 다양한 문제를 노출하고 있음. 실제 이 치료제들은 3~5억 원 수준의 높은 약가를 형성하고 있음
□ 자가치료 방식으로 인해 발생하는 다양한 문제를 해결하는 전략이 동종치료(allogeneic therapy)임. 건강한 공여자로부터 T세포를 얻어 CAR를 도입한 후 환자의 치료에 사용하는 방식으로 이 또한 이식편대숙주질환(graft-versus-host disease; GVHD)의 문제를 갖고 있음
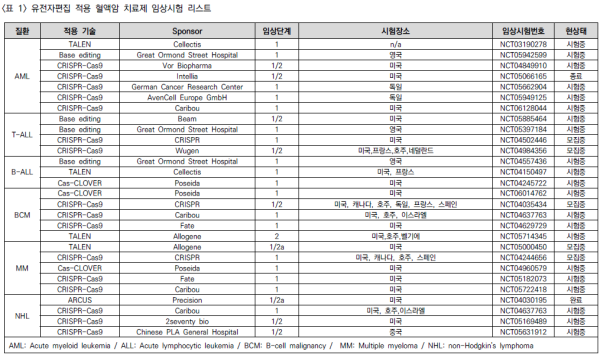
□ GVHD에 관여하는 두 분자인 TCR과 MHC의 발현에 관여하는 유전자를 제거함으로써 환자에게 사용하고자 하는 치료제를 개발함에 있어 타인인 공여자로부터 얻어진 T세포를 활용하는 것이 차세대 CAR-T 치료법으로 인식되고 있음. 따라서 해당 유전자를 제거하기 위해 유전자가위 도구가 이용되고 있으며 다양한 회사들이 동종 CAR-T 개발에 뛰어들고 있음. 현재까지 승인된 약물은 없으며 다양한 약물들이 현재 임상시험 중임 <표 1>
□ CRISPR-Cas9 기술이 주요 기술로 활용되고 있는 가운데 염기교정 기술, TALEN, ARCUS 등 몇몇 기술이 동종 CAR-T 개발이라는 공통 목표를 두고 혈액암 치료제 개발 영역에서 경쟁하고 있음. 주로 미국을 중심으로 임상시험이 진행되고 있지만, 안전성이 어느 정도 입증되어 유럽, 호주까지 확대된 다국적 임상시험이 수행되고 있음. 유효성까지 입증될 경우 기존의 자가 CAR-T 치료제를 대체할 주요 치료제로 인식되고 있음
□ 기존 동종 CAR-T 치료제의 두드러진 한계 중의 하나는 혈액암 치료제에 한정되어 있다는 점임. 혈액을 통한 면역세포의 자유로운 이동능력과 CAR에 의한 암세포 인식능력을 활용하여 CAR-T를 고형암 치료제로 확대하려는 노력이 또 하나의 주요 움직임임
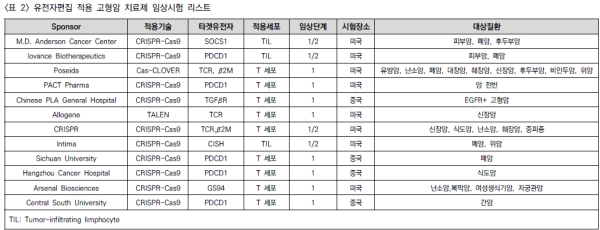
□ 이를 위해 동종 혈액암 치료제 개발에 채택되었던 면역거부 억제 전략과 함께 면역관문 억제제인 PD-1, TGF-β, SOCS1 등 암세포 신호전달에 관련된 유전자를 넉아웃함으로써 고형암 치료 효과를 높이려는 전략들이 채택되어 현재 임상시험이 진행되고 있음 <표 2>
□ 이 임상시험의 특징은 CAR-T 단독투여뿐 아니라 단일항체들과의 병용투여 전략들이 시도되고 있는 것임. 아직은 안전성 확인 단계이므로 미국 중심의 임상시험이 진행되고 있음. 다만 PD-1 넉아웃 전략의 임상시험은 미국 외에 중국에서 활발하게 진행되었으나 최근에 괄목할만한 진행 상황이 관찰되고 있지는 않음
□ 즉 유전자가위 기술이 CAR-T 치료기술과 접목되어 동종 혈액암 및 고형암 치료 영역에 적용되면서 향후 암 치료의 판도를 바꿀 주요 치료전략으로 자리매김할지 귀추가 주목되고 있음
5. 희귀유전질환 치료제 개발
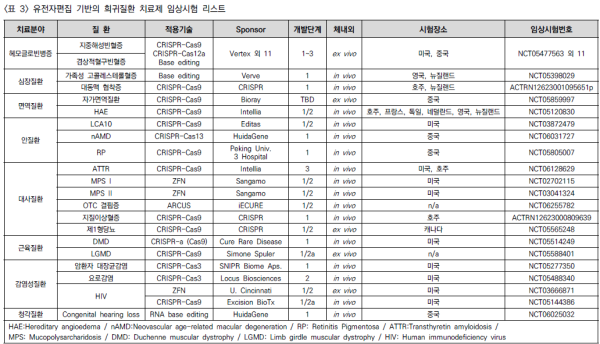
□ 암 치료 영역에서 CAR-T 기반 세포치료기술과 유전자가위 기술의 접목이 시도되었고 희귀유전질환 영역은 유전자가위 기술 기반 치료제 개발이 시도되고 있음 <표 3>
□ 기술한 바와 같이 ex vivo 영역에서 ‘카스게비’처럼 승인된 사례가 나왔고 유사한 전략으로 임상시험이 진행되고 있는 연구들이 다수 존재함. 버텍스 파마슈티컬스와 크리스퍼 테라퓨틱스가 적용하였던 CRISPR-Cas9 외에 에디타스 메디신의 CRISPR-Cas12a, 빔 테라퓨틱스의 염기교정 기술들이 적용되고 있음
□ 다만 이들 ex vivo 치료제는 지중해성빈혈증, 겸상적혈구빈혈증과 같은 헤모글로빈병증 관련 질환에 집중되어 있음. 이들의 공통적인 전략은 BCL11A의 발현을 억제함으로써 감마글로빈의 양을 늘리는 것임. 다만 BCL11A의 인핸서를 제거하는 전략을 가졌던 카스게비와는 달리 빔 테라퓨틱스와 에디타스 메디신은 BCL11A가 결합하는 조절 부위를 편집함으로써 같은 효과를 노리고 있음. 어떤 전략이 비교우위에 있을지는 현재 임상 치료제의 POC 결과를 확보한 후 판단할 수 있을 것임
□ CRISPR 유전자가위가 적용된 독특한 적응증의 하나는 제1형 당뇨병임. 버텍스 파마슈티컬스와 비아사이트(Viacyte)가 공동개발하고 있는 ‘VCTX210’는 동종유래 줄기세포의 면역거부인자를 제거하여 체내 생존기간을 늘림으로써 베타세포가 파괴된 당뇨병 환자에게 지속적으로 인슐린을 공급하는 치료제임. 동종세포 기반의 또 다른 proof-of-concept의 치료제가 될 것으로 생각되며 치료제 개발 성공시 큰 파장을 일으킬 것으로 예상됨
□ 지금까지 기술한 ex vivo 치료제와는 달리 in vivo 치료제가 주요 희귀유전질환 치료방식으로 채택될 것으로 예상하고 있음. 사실상 ex vivo 전략으로 접근 가능한 치료제는 한정적인 데 반해 대부분 치료제는 in vivo 접근을 통해서 가능하기 때문임. in vivo 치료적 접근이 가능하기 위해서는 해당 조직에 전달이 가능한 전달체의 개발이 동반되어야 함. 현재 검증된 in vivo 전달체는 지질나노입자(LNP)와 AAV 바이러스임
□ LNP는 간(liver) 조직 전달이 용이하고 전달 가능한 페이로드의 제한이 적어 비교적 크기가 큰 CRISPR-Cas9 전달에 적합함. 이러한 이유로 Cas9 mRNA와 gRNA를 LNP에 봉입하여 간에 전달하는 방식의 치료제 개발이 in vivo에서 가장 활발한 영역에 속함
□ 아직 승인된 사례는 없지만 인텔리아 테라퓨틱스의 트랜스티레틴 아밀로이드증(ATTR Amyloidosis) 치료제인 ‘NTLA-2001’이 상업화에 가장 근접한 치료제로 예상됨. 환자의 혈중 ATTR을 90% 수준까지 감소시키는 결과를 보여준 전임상 결과[6]를 바탕으로 현재 임상 3상이 시작되었으며 2~3년 내에 최초의 in vivo 유전자편집 치료제가 될 것으로 예상됨. 이 외에도 인텔리아 테라퓨틱스는 HAE, A1ATD 등의 질환에 대한 in vivo 치료제 임상연구를 연이어 계획, 진행하고 있음
□ 최근 최초의 in vivo 염기교정 치료법인 버브 테라퓨틱스의 ‘Verve-101’의 임상이 실패함. PCSK9 유전자의 splicing site를 염기교정하여 해당 유전자의 넉아웃을 유도함으로써 LDL 함량을 낮추는 치료제로 가족성 고콜레스테롤혈증의 치료제로 임상시험이 시도되었음. 하지만 임상 시험자 중 한 명에게서 3등급의 간 독성이 관찰되어 임상이 중단됨에 따라 당분간 염기교정 기반의 in vivo 치료제 승인은 시간이 걸릴 것으로 예상됨.
하지만 버브 테라퓨틱스는 임상시험 중 발생한 간 독성이 염기교정 기술 때문이 아닌 전달체 때문으로 판단하고[7] GalNAc이 결합된 전달체로 바꾼 ‘Verve-102’로 임상 개시 계획을 발표함
□ AAV의 페이로드 사이즈 제한의 문제로 in vivo 적용이 쉽지 않았던 SpCas9과는 달리 비교적 사이즈가 작은 SaCas9이 개발되어[8] 임상적용이 시도됨. 에디타스 메디신의 ‘EDIT-101’은 LCA10 환자에서 발생하는 IVS26 변이를 교정함으로써 소실된 시각을 회복시키는 치료제임. SaCas9과 gRNA 한 쌍을 포함한 페이로드를 AAV5에 패키징한 후 이를 망막 하 투여하여 시신경 세포의 유전자교정을 유도하는 치료제로 임상시험 결과 주로 IVS26 homozygous 환자에게만 효과를 보이는 것으로 나타나 상업성의 실패로 임상이 중단됨
□ 희귀유전질환이 아닌 감염성 질환에서도 유전자편집 치료제가 시도되고 있음(감염성 질환은 유전질환에 해당되지 않지만 <표 3>에 추가). 감염성 질환은 크게 HIV로 대표되는 바이러스성 감염질환과 대장균에 의한 박테리아성 감염질환으로 구분됨. HIV 치료제는 초창기 상가모 테라퓨틱스에 의해 ZFN 기반의 ex vivo 치료법이 시도되었으나 현재는 임상이 중단되었고 대신 CRISPR 기반의 in vivo 치료법이 시도되고 있음. 대장균 감염 치료는 대장균 감염이 가능한 박테리오파지를 이용하는 것으로 대부분의 Class II CRISPR가 아닌 Class I의 type I CRISPR을 장착하고 있음. CRISPR가 장착된 박테리오파지는 대장균을 선별적으로 감염하여 대장균 살상 효과를 노리게 됨. 적용 가능한 적응증은 혈액암 환자에게서 나타나는 패혈증 또는 요로감염증임
6. 향후 개발 움직임
□ 유전자가위 기술의 편집방식은 다음과 같이 크게 네 가지 형태로 구분할 수 있음. 1) 전통적 이중나선 DNA 절단 방식 2) 염기교정, 프라임 에디팅 기술처럼 DNA를 절단하지 않는 DNA 교정 방식 3) CRISPR-a/i 기술로 대변되는 전사조절 4) Cas13 기반 mRNA 조절 방식. 현재 전통적 DNA 절단 방식의 편집기술이 임상에 적용되고 있다면 미래에는 나머지 세 방식의 편집기술의 치료적 시도가 생길 것으로 예상됨
□ 염기교정 기술은 빔 테라퓨틱스가 다양한 글로벌 제약사와의 협력을 통해 치료제 개발을 시도하는 것과 최근의 버브 테라퓨틱스의 임상 실패 사례와 추후 파이프라인의 성공 열쇠가 주요 변수임. 프라임 에디팅 기술은 기술의 잠재력에 비해 아직 눈에 띈 치료적 적용 사례는 없으나 어느 적응증에서 첫 POC를 검증하게 될지가 관심사가 되고 있음
□ CRISPR-a/i 기술은 DNA를 절단하지 않고 유전자발현을 조절할 수 있다는 점에서 안전성 측면의 비교우위를 지니고 있음. activator, repressor를 장착하는 범위를 넘어 다양한 epigenetic regulator를 장착함으로써 비교적 durable한 치료 효과를 노리려는 시도가 있음. 미국의 관련 회사로는 Navega, Tune, Chroma, Modalis 등이 있음. 현재 Cas13 기술을 이용한 Huidagene의 습성 연령관련 황반변성(nAMD) 치료제 개발이 유일하나 수년 내에 다양한 파이프라인이 올라올 것으로 예상됨
□ CRISPR-Cas13 기술은 최종적으로 mRNA의 체내량을 감소시킨다는 측면에서 CRISPR-i 기술과 맥을 같이 함. 이 경쟁 관계의 모달리티 중에 치료제의 특이성, 효능, 전달성, 약효 지속성의 측면에서 보다 나은 결과를 보인 치료기술이 대세가 될 것으로 예상됨. RNAi나 ASO 기술과도 경쟁관계에 있으며 나름대로의 자리매김을 위해 다양한 기술들이 접목될 것으로 예상됨
□ 기존 희귀질환 치료 모달리티는 단백질보충치료, 핵산치료를 거쳐 AAV 전달 기반 유전자치료제로 이어져 왔음. 앞의 두 치료는 반복투여를 해야 하는 불편함과 적응증이 일부 질환에 한정적이었고 AAV 유전자보충 치료제는 치료 효과가 영구적이지 않은 상황에서 반복투여가 힘들다는 한계가 존재함. 유전자편집 치료제가 이러한 문제를 극복할 수 있는 대안이 될 수 있음. 다만 많은 유전질환은 다양한 변이가 존재하고 주요 변이가 명확하지 않은 경우 소수의 환자에 국한된 치료제가 개발되어야 한다는 점에서 글리베라(Glybera)의 역설*을 떠올리게 됨
* 글리베라의 역설: AAV 전달기반 유전자치료제의 최초 승인 제품인 uniQure의 글리베라는 최초 유럽승인을 받았으나 환자 수가 너무 적어 상업성을 확보하지 못해 시장에서 퇴출됨 |
□ 즉 유전자 변이 형태와 무관하게 특정 유전질환 환자를 모두 커버할 수 있는 치료제의 개발이 기대되는데 바로 이것이 유전자삽입 기술(gene integration)임. 현재 유수의 저널에 몇몇 기술이 소개되어 연구단계에 있으나 치료제 개발까지 이루어지고 있지는 않음. 가장 큰 걸림돌은 낮은 효율과 비표적 삽입으로 인한 안전성의 문제로 이 문제들을 해결할 수 있는 솔루션과 전달체 기술이 합쳐진다면 희귀질환 치료의 새로운 국면을 맞을 수 있을 것임
□ 유전자편집 치료제 발전에 있어 주요하게 작용할 또 다른 기술요인은 다양한 전달체 개발임. 주요 전달체인 LNP와 AAV 분야도 독자적인 플랫폼이나 엔지니어링을 통해 더 진화하려는 노력을 거듭하고 있음. 특히 AAV가 갖는 단점을 극복하려는 바이오텍 기업들이 최근 큰 두각을 나타내고 있어 유전자치료의 부흥을 견인하는 주요 인자가 될 것으로 예상됨. 또한 엑소좀, VLP 등 생체유래 전달체까지 가세하고 있어 유전자가위 도구를 전달할 수 있는 많은 옵션이 마련된다면 향후 유전자편집 치료제의 응용범위는 크게 확대될 것으로 전망됨
□ 전달체의 전달 사이즈의 한계를 극복하기 위하여 다양한 미생물 종에서 작은 유전자 발굴 및 개량이 이루어지고 있음. 이미 널리 사용하고 있는 SpCas9는 1,368개의 아미노산으로 이루어져 AAV와 같이 페이로드 한계가 명확한 전달체에는 적합하지 않음. 현재 SpCas9(1,368 aa)보다 작은 NmCas9(1,082 aa), SaCas9(1,053 aa), CjCas9(984 aa) 등보다 작은 유전자가위가 발굴되었고 Cas12f, TnpB, IscB와 같이 2.0 kb 이하의 초소형 유전자가위들이 보고되고 있음. 따라서 이들 CRISPR 기술과 AAV와 같은 바이러스 전달체와의 융합이 향후 치료제 개발을 이끌 주요 축으로 부상할 것으로 예상됨
7. 맺음말
□ 희귀질환 포털인 Orphanet[9]에 의하면 2017년 기준 약 9,400여 종류의 희귀질환이 있으며 원인 돌연변이가 알려진 질환은 3,700여 개임. 인구수로는 전 세계 3억 5천만 명, 국내 48만 명임
□ 근본적으로 유전자 변이에 의해 발생하므로 잘못된 변이의 ‘고쳐쓰기’를 통해 근본적인 치료가 가능하다고 할 수 있음. 따라서 비교적 유병률이 높고 단백질 보충요법과 같은 대체요법이 가능한 몇 종류를 제외하면 그동안 많은 희귀질환자가 근본적인 치료 없이 대증적인 요법에 의존해왔음
□ 유전자가위 도구 기술의 발전과 전달체 기술의 동반 발전, 유전자치료 임상경험의 축적으로 인해 향후 많은 희귀유전질환 및 난치질환에 대한 많은 ‘one-time’ 치료제가 상용화될 것이며 유전질환을 넘어 퇴행성질환 및 노화에 이르기까지 그 영역이 확대될 것으로 기대됨
8. 참고문헌
[1] Jinek M. et al. A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial Immunity. Science 337, 816-821 (2012).
[2] Cong L. et al. Multiplex genome engineering using CRISPR/Cas systems. Science 339, 819–823 (2013).
[3] Mali P. et al. RNA-guided human genome engineering via Cas9. Science 339, 823–826 (2013).
[4] Cho S.W. et al. Targeted genome engineering in human cells with the Cas9 RNA-guided endonuclease. Nat. Biotechnol. 31, 230–232 (2013).
[5] https://finance.yahoo.com/news/heres-1-key-reason-might-105300499.htmlguccounter=1&guce_referrer=aHR0cHM6Ly93d3cuZ29vZ2xlLmNvbS8&guce_referrer_sig=AQAAAEHQcg3oO87isoibhQLtAbc9m_HBUTENuXMeeZA_qwvPvmhHvBgGOtjN8sm3TNcQj-QTaKLD4Kk0-lTs5Up_oIArRidrqQChQ9DwkvGesWyEDdREIbCTszLS7f1WmUG1hfIctdUyqC_3BtBNLXJ1nhzpKEqMW-_mlFP6WMfTY8kS
[6] Musunuru K. et al. In vivo CRISPR base editing of PCSK9 durably lowers cholesterol in primates. Nature 593, 429-434 (2021)
[7] https://www.fiercebiotech.com/biotech/verve-halts-enrollment-lead-trial-after-grade-3-side-effects-prioritizing-next-pcsk9-editor
[8] Ran F.A. et al., In vivo genome editing using Staphylococcus aureus Cas9. Nature 520, 186-191 (2015).
[9] www.orpha.net
* 본 기고문은 과학기술정보통신부에서 시행한 「유전자편집·제어·복원기반기술개발사업」수행의 일환으로 작성되었습니다.
* 본 내용은 유전체편집연구지원사무국(GERC)의 의견과 다를 수 있음을 밝힙니다.
* 인용, 발표하실 때에는 반드시 출처를 밝혀주시기 바랍니다.